1. 堚揱巕忣曬敪尰丂摿偵丄揮幨怢挿斀墳偺惂屼婡峔偺夝柧
変乆偼僎僲儉偐傜偺忣曬敪尰丄摿偵揮幨怢挿斀墳偺惂屼儊僇僯僘儉偵偮偄偰尋媶偟偰偒傑偟偨丅僸僩偼僞儞僷僋幙傪僐乕僪偡傞堚揱巕傪2枩悢愮屄帩偭偰偄傑偡丅偙傟傜惗暔傪峔惉偡傞僷乕僣1偮侾偮偺婡擻傪柧傜偐偵偡傞偙偲偼丄惗柦傪棟夝偡傞丄偲偄偆尋媶偺僑乕儖偵岦偗偨廳梫側棦掱昗偱偁傝丄尰戙偺懡偔偺惗柦壢妛幰偑庢傝慻傫偱偄傞偲偙傠偱偡丅変乆偼丄偙偺2枩揰梋傝偺僷乕僣傪懱偺偳偺晹暘偱丄偄偮丄偳傟偔傜偄嶌傞偐丄偲偄偆惗暔偺崻姴偵娭傢傞寛掕傪扴偆暘巕憰抲偵偮偄偰尋媶傪峴偭偰偄傑偡丅
揮幨偺傛偆側暋嶨側惗柦尰徾傪棟夝偡傞忋偱丄掅暘巕壔崌暔偱偁傞慾奞嵻偼桳岠側僣乕儖偲側傝摼傞偙偲傪尒弌偟偨偺偱丄偙偙偵徯夘偟傑偡丅偦偺慜偵丄偦傟偵帄偭偨宱堒傪娙扨偵弎傋傑偡丅傑偢丄摿堎墫婎攝楍傪娷傓DNA傪変乆偑撈帺偵奐敪偟偨SG/FG價乕僘偵屌掕壔偟丄偦傟偵傛傝丄ATF/
CREB揮幨場巕僼傽儈儕乕偺8偮偺慡儊儞僶乕傪嵶朎妀慹拪弌塼偐傜捈偵傾僼傿僯僥傿惛惢偱偒傑偡丅偟偐傕丄p俁侽侽偲屇偽傟傞儊僨傿僄乕僞乕傗僞儞僷僋幙僉僫乕僛偑丄揮幨場巕偲嫟偵暘棧偝傟傞偙偲傪尒弌偟偨偙偲偐傜丄僉僫乕僛妶惈偑揮幨場巕偵傛偭偰僾儘儌乕僞忋偵儕僋儖乕僩偝傟丄揮幨偵壗傜偐娭梌偟偰偄傞偐傕抦傟側偄偲壇應偟傑偟偨丅偦偙偱丄偦偺僉僫乕僛妶惈偺慾奞嵻傪扵嶕偟丄DRB偲屇偽傟傞傾僨僲僔儞桿摫懱傪尒弌偟傑偟偨丅
偙傟偑DRB偲偺弶傔偰偺弌夛偄偱偡丅摉帪丄DRB偼僞儞僷僋幙僉僫乕僛P-TEFb偺慾奞偲揮幨慾奞偺椉曽偺妶惈傪帩偮偙偲偑抦傜傟偰偄傑偟偨偑丄椉妶惈偺娫偺娭學偼傢偐傝傑偣傫偱偟偨丅偦偙偱丄変乆偼揮幨偺暘巕婡峔傪夝柧偡傞偨傔偵丄DRB偲偄偆揮幨慾奞嵻/僞儞僷僋幙僉僫乕僛慾奞嵻傪梡偄傑偟偨丅偦偟偰DRB偑揮幨傪慾奞偡傞儊僇僯僘儉偺夝愅傪捠偠偰丄揮幨惂屼偺傑偭偨偔怴偟偄儊僇僯僘儉傪敪尒偡傞偵帄傝傑偟偨丅偙傟傪宊婡偵丄働儈僇儖僶僀僆儘僕乕偺廳梫惈傪恎偵偟傒偰擣幆偟丄偙偺暘栰偺尋媶偵懌傪撍偭崬傓偙偲偵惉偭偰偟傑偄傑偟偨丅偙傟偵娭偟偰偼丄乽俁丏働儈僇儖僕僃僱僥傿僋僗/働儈僇儖僶僀僆儘僕乕偵徻偟偔徯夘偟偰偄傑偡丅
揮幨丄偡側傢偪mRNA慜嬱懱偺崌惉斀墳偼丄奐巒慜丄奐巒丄怢挿丄廔寢偲偄偆係偮偺抜奒偐傜峔惉偝傟偰偄傑偡丅変乆偑DRB偵傛傞揮幨慾奞婡峔偺尋媶傪僗僞乕僩偝偣偨崰偼丄奐巒慜抜奒偙偦偑暋嶨偵挷愡偝傟丄堚揱巕敪尵惂屼偵嵟傕廳梫偩偲峫偊傜偊傟偰偄偨偺偱偡丅偟偐偟丄埲壓偱愢柧偡傞傛偆偵丄揮幨怢挿抜奒傕傑偨嬌傔偰暋嶨偵僟僀僫儈僢僋偵惂屼偝傟偰偄傞偙偲偑丄変乆偺尋媶傪捠偠偰偁偒傜偐偲側傝丄偦偺廳梫惈偼尰嵼偱偼峀偔擣抦偝傟偰偄傑偡丅偦偙偱丄埲壓偵変乆偑悽奅偵愭嬱偗偰夝偒柧偐偟偨mRNA崌惉懍搙偺僟僀僫儈僢僋側惂屼傪奣愢偟傑偡丅
変乆偼丄傑偢丄DRB偑怢挿抜奒偱RNA億儕儊儔乕僛嘥嘥乮Pol嘥嘥乯偺堦帪掆巭乮怢挿掆巭乯傪桿摫偡傞偙偲偵傛偭偰揮幨傪慾奞偡傞偙偲傪尒弌偟傑偟偨乮憤愢丗Yamaguchi丂et
al.,Genes Cells. 1998)丅偦偟偰丄偙偺怢挿掆巭傪捈愙堷偒婲偙偡場巕偲偟偰変乆偼丄乭DSIF乭偲乭NELF乭偲偄偆僞儞僷僋幙場巕乮揮幨怢挿場巕乯傪in
vitro揮幨宯偍傛傃偦偺嵞峔惉宯偵傛傝敪尒偟傑偟偨(Wada et al.,Genes Dev.,1998;Yamaguchi et al.,Cell,1999)丅DSIF偼Pol丂嘥嘥偲捈愙寢崌偟丄偦偙偵偝傜偵RNA寢崌妶惈傪帩偮NELF偑寢崌偡傞偙偲偱丄Pol嘥嘥偺mRNA崌惉斀墳偑堦帪揑偵慾奞偝傟傑偡乮Yamaguchi
et al.,J.Biol.Chem.,1999;Yamaguchi et al.,Mol. Cell.Biol.,2002)丅堦帪揑偲偄偆偙偲偼丄mRNA崌惉傪堦扷掆巭偟偨Pol
嘥嘥偑mRNA傪嵞奐偱偒傞偲塢偆偙偲偱偡丅Pol嘥嘥偵捈愙寢崌偟偰丄mRNA崌惉傪慾奞偡傞場巕DSIF偲NELF偺敪尒偼悽奅偱偼偠傔偰偺偙偲偱丄偦傟傜場巕偺寢崌偵傛傝丄Pol嘥嘥偼揮幨奐巒揰乮+侾乯偐傜亄30乣亄50偺壓棳晹埵偱怢挿掆巭偟傑偡丅偙偺惉壥偼丄擬僔儑僢僋堚揱巕側偳偙傟傑偱塢傢傟偰偒偨僾儘儌乕僞嬤埵偺掆巭乮promoter
proximal pausing 乯偲摨堦偱偁傞偙偲偑嬤擭偁偒傜偐偵側傝丄偦偺儊僇僯僘儉夝柧偵戝偄偵峷專偡傞偙偲偑偱偒傑偟偨丅
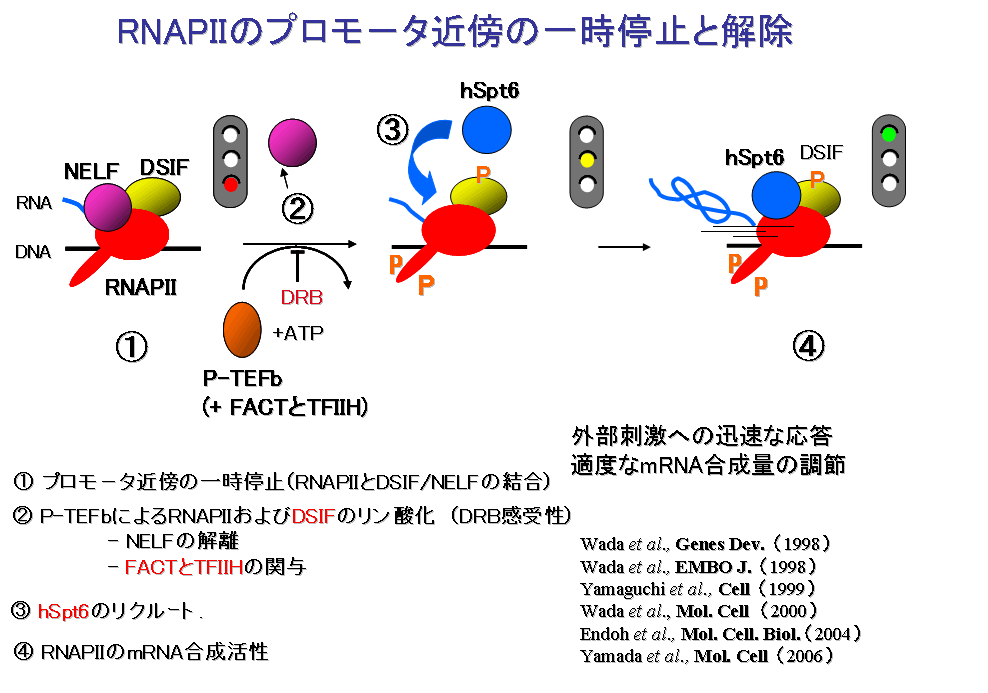
DSIF偲NELF偵傛傞Pol嘥嘥偺怢挿掆巭偼丄傾僀僆儚戝妛偺D.Price嫵庼偑摨掕偟偨P-TEFb偲偄偆僞儞僷僋幙僉僫乕僛偵傛偭偰夝彍偝傟傞偙偲傕変乆偼尒弌偟傑偟偨丅(Wada et al.,EMBO J.,1998)丅P-TEFb偼Pol嘥嘥偺C抂枛僪儊僀儞(CTD)偲屇偽傟傞摿庩側孞傝曉偟峔憿傪儕儞巁壔偡傞偙偲偵傛偭偰丄Pol嘥嘥/DSIF/NELF偐傜惉傞暋崌懱偐傜NELF偑夝棧偝傟丄偦傟偵傛偭偰揮幨偺怢挿掆巭偑夝彍偝傟丄揮幨偑嵞奐偝傟傑偡(Yamaguchi et al.,Cell,1999)丅傑偨丄変乆偼怢挿掆巭偺夝彍偑P-TEFb偩偗偱偼晄廫暘偱偁傝丄FACT偲TF嘥嘥H偲偄偆懠偺僞儞僷僋幙場巕偑娭梌偡傞偙偲傪柧傜偐偵偟傑偟偨(Wada et al.,Mol.Cell,2000)丅偙偺応崌丄TF嘥嘥H偼偦偺僉僫乕僛妶惈偱偼側偔丄僿儕僇乕僛妶惈偑廳梫偱偁傞偙偲傪帵偟傑偟偨丅偝傜偵丄怢挿掆巭偺夝彍偵敽偭偰丄hSpt6偲偄偆僞儞僷僋幙場巕偑Pol嘥嘥忋偵儕僋儖乕僩偝傟丄Pol嘥嘥偺mRNA崌惉妶惈傪槾恑偡傞偙偲傕尒弌偟傑偟偨(Endou et al.,Mol.Cell.Biol.,2004)丅
恀妀惗暔偵偍偗傞揮幨偼丄奐巒抜奒偲怢挿抜奒偱偺怢挿掆巭偲偄偆擇偮偺抜奒偱岻柇偵惂屼偝傟偰偄傞偙偲偑変乆偺尋媶偵傛偭偰暘偐偭偰偒傑偟偨丅偮傑傝丄揮幨偵偼岎捠怣崋婡偑擇偮偁傝丄偦傟傜擇偮偱鉱枾偵惂屼偝傟偰偄傞偲塢偆偙偲偱偡丅奐巒抜奒偵偍偗傞堦斣栚偺怣崋婡偱mRNA崌惉検偑戝傑偐偵寛傔傜傟丄怢挿抜奒偱偺擇斣栚偺怣崋婡偱mRNA崌惉検偑揑妋偵惂屼偝傟傞偲塢偆傕偺偱偡丅偙傟偼丄敪惗傗嵶朎暘壔抜奒偵偍偄偰奜晹巋寖偵傛傝桿摫敪尰偝傟傞堚揱巕偺杦偳偡傋偰偺敪尰偼丄僾儘儌乕僞忋偺奐巒暋崌懱偺宍惉昿搙乮奐巒抜奒乯偲丄怢挿掆巭偺夝彍昿搙乮怢挿抜奒乯偲偺擇偮偺抜奒偱惂屼偝傟偰偄傑偡丅偦偺寢壥丄奐巒昿搙偑槾恑偝傟夁偓偰傕丄怢挿掆巭抜奒偵偍偗傞夝彍昿搙偵傛偭偰mRNA崌惉検偑揑妋偵挷愡偝傟丄嵟揔側検偑崌惉偝傟傞偙偲偵側傝傑偡丅偙偺擇抜奒惂屼偼丄摿掕堚揱巕偺乭帪娫揑丒嬻娫揑乭側敪尰挷愡偵嬌傔偰廳梫偱偐偮崅搙側惂屼婡峔偱偁傞偙偲傕尒弌偟傑偟偨(Aida
et al.,Mol.Cell.Biol.,2006)丅戝帠側惗柦尰徾偵娭傢傞杦偳偡傋偰偺堚揱巕偺敪尰偼揮幨奐巒昿搙傛傝傕丄傓偟傠怢挿掆巭偲偦偺夝彍偵傛傞挷愡偵傛偭偰丄mRNA崌惉検偑懡夁偓傕偣偢彮側夁偓傕偣偢丄揔検傪崌惉偡傞旕忢偵崅搙側惂屼婡峔偲塢偊傑偡丅偪側傒偵丄偙偺傛偆側惂屼偼壓摍惗暔偵偼尒傜傟偢丄崅摍惗暔偱偟偐懚嵼偟傑偣傫丅
傑偨丄DSIF偵偼揮幨怢挿傪NELF偲嫤挷偟偰梷惂偡傞偩偗偱側偔丄怢挿妶惈傪懀恑偡傞摥偒傕偁傝丄揮幨怢挿斀墳傪惓乮傾僋僙儖乯偲晧乮僽儗乕僉乯偺椉曽偵惂屼偱偒傞儐僯乕僋側場巕偩偲偄偆偙偲傪柧傜偐偵偟傑偟偨丅懀恑妶惈偵偮偄偰偼枹偩傛偔暘偐偭偰偄傑偣傫偱偟偨偑丄嵟嬤変乆偼丄DSIF偺僽儗乕僉場巕偐傜傾僋僙儖場巕傊偺婡擻愗傝姺偊偵丄P-REF倐偵傛傞DSIF偺儕儞巁壔偑娭梌偡傞偙偲傪敪尒偟傑偟偨乮Yamada
et al.,Mol.Cell,2006乯丅偙偺儕儞巁壔偼乣2,400Kb傕偁傞僕僗僩儘僼傿儞堚揱巕偺傛偆側戝偒側僒僀僘偺揮幨偵偼晄壜寚偱偁傞偲峫偊傜傟傑偡丅傑偨丄嫽枴怺偄偙偲偵丄P-TEFb偵傛偭偰儕儞巁壔偝傟傞DSIF偺攝楍偼丄Pol嘥嘥偺CTD偵椶帡偟偨俆偮偺傾儈僲巁攝楍偺孞傝曉偟峔憿傪偟偰偍傝丄変乆偼偙傟傪C枛抂椞堟乮CTR乯偲柤晅偗傑偟偨丅
偙傟傑偱偼丄庡偵帋尡娗撪偱偺cell free宯偱丄惗壔妛傗暘巕惗暔妛傪嬱巊偟偰摼傜傟偨尋媶惉壥偱偡偑丄惗暔屌懱傗攟梴嵶朎儗儀儖偱偺抦尒傕偄偔偮偐摼傜傟偰偒偰丄揮幨怢挿惂屼偵娭傢傞DSIF傗NELF偑壥偨偡惗暔妛揑側廳梫惈偵偮偄偰丄埲壓偺傛偆側尋媶惉壥偑偙傟傑偱偵変乆帺恎偍傛傃嫟摨尋媶偵傛偭偰摼傜傟偰偄傑偡丅
乮侾乯敪惗丄暘壔抜奒偵偍偗傞栶妱
丂DSIF偺傾僋僙妶惈偼惓忢偱丄僽儗乕僉妶惈偺傒偑懝側傢傟偨揰曄堎傪帩偮僛僽儔僼傿僢僔儏偼丄恄宱嵶朎偺暘壔偵堎忢傪偒偨偟丄僪乕僷儈儞嶌摦惈僯儏乕儘儞偺悢偑尭彮偟丄戙彏揑偵僙儘僩僯儞嶌摦惈僯儏乕儘儞悢偑憹壛偡傞偙偲傪変乆偼尒弌偟傑偟偨乮Guo
et al.,Nature,2000乯丅偙傟偼DSIF偑恄宱鉭姴嵶朎偺暘壔挷愡偵傕娭梌偡傞偙偲傪帵偡傕偺偱偡丅傑偨丄僔儑僂僕儑僂僶僄偵偍偗傞摨條偺曄堎偑DSIF偵婲偙傞偲丄懱愡宍惉偵堎忢傪棃偨偡偙偲偑暘偐傝傑偟偨乮Jennings
et al.,Curr.Biol.,2004乯丅
乮俀乯懡條側巋寖墳摎惈偺堚揱巕敪尰偵偍偗傞栶妱
丂奜晹巋寖偵墳摎偟偰恦懍偵桿摫敪尰偝傟傞懡偔偺堚揱巕丄椺偊偽擬僔儑僢僋墳摎惈堚揱巕丄墛徢惈僒僀僩僇僀儞墳摎惈堚揱巕丄惈儂儖儌儞墳摎惈堚揱巕丄憹怋巋寖墳摎惈堚揱巕側偳偑揮幨怢挿抜奒偱偺堦帪掆巭偵傛傝惂屼傪庴偗偰偍傝丄巋寖慜偐傜僾儘儌乕僞嬤埵偵Pol嘥嘥偑掆巭忬懺偵偁偭偰丄巋寖屻懍傗偐偵斀墳偟偰揮幨偑嵞奐偝傟傞偙偲傪変乆偼柧傜偐偵偟傑偟偨乮Wu et al.,Genes Dev.,2003; Ainbinder et al.,Mol.Cell.Biol.,2004; Aiyar et al.,Genes Dev.,2004; Yamada et al.,Mol. Cell,2006; Aida et al., Mol.Cell. Biol.,2006乯丅
乮俁乯昦尨惈僂傿儖僗偺憹怋偵偍偗傞栶妱
丂僸僩柶塽晄慡僂傿儖僗乮HIV)偺愽暁姶愼帪丄HIV偺僾儘儌乕僞乕嬤朤偱偼Pol嘥嘥偑堦帪掆巭偟偰偄傑偡偑丄偙傟偼DSIF偲NELF偵傛傝掆巭偑堷偒婲偙偝傟傑偡乮Kim
et al.,Mol.Cell.Biol.,1999; Yamaguchi et al.,Microbes Infect.,2002乯丅HIV偵僐乕僪偝傟傞Tat僞儞僷僋幙偼P-TEF倐傪HIV偺僾儘儌乕僞嬤朤偵儕僋儖乕僩偟丄堦帪掆巭偟偰偄傞Pol嘥嘥偺CTD偺儕儞巁壔傪桿摫偟偰丄mRNA崌惉傪嵞奐丒懀恑偟傑偡丅
丂傑偨丄D宆娞墛僂僀儖僗偵僐乕僪偝傟傞僨儖僞峈尨偼丄NELF偲嫞崌揑偵Pol嘥嘥偵寢崌偟丄Pol嘥嘥偺揮幨怢挿妶惈傪懀恑偡傞偙偲偵傛傝丄HDV偺mRNA崌惉傪懀恑偟傑偡乮Yamaguchi
et al.,Science,2001乯丅偙偺儊僇僯僘儉偼戝曄嫽枴偁傞強偱丄僂僀儖僗僞儞僷僋幙偺拞偱Pol嘥嘥偵捈愙嶌梡偟偰丄揮幨怢挿妶惈傪懀恑偡傞偺偼丄偙傟傑偱曬崘椺偑側偔丄変乆偺尒弌偟偨僨儖僞峈尨偑弶傔偰偱偡丅
乮係乯mRNA僾儘僙僔儞僌偵偍偗傞栶妱
DSIF偑倣RNA偺僉儍僢僺儞僌峺慺偺妶惈傪槾恑偡傞偙偲傪尒弌偟傑偟偨乮Mandel et al.,Proc.Natl.Acad.Sci.USA,2004乯丅傑偨丄僸僗僩儞堚揱巕偺mRNA慜嬱懱偼丄僉儍僢僾峔憿傪俆乫枛抂偵帩偮偑丄億儕A偺柍偄僗僥儉儖乕僾峔憿傪俁乫枛抂偵帩偪丄摿庩側俁乫枛抂僾儘僙僔儞僌傪庴偗傑偡丅変乆偼丄偦偺僾儘僙僔儞僌偵NELF偲mRNA偺僉儍僢僾寢崌場巕CBC偑娭梌偡傞偙偲傪尒弌偟傑偟偨乮Narita
et al.,Mol.Cell,2007乯丅僗僾儔僀僔儞僌側偳偺倣RNA偺僾儘僙僔儞僌斀墳偼揮幨屻偵婲偙傞傕偺偲廬棃峫偊傜傟偰偄傑偟偨偑丄嵟嬤偦傟傜偑揮幨偲帪嬻娫揑偵枾愙偵嫟栶偟偰偍偙偭偰偄傞偙偲偑暘偐偭偰偒傑偟偨丅偝傜偵丄変乆偺偙偺尋媶偐傜丄揮幨怢挿場巕偼揮幨怢挿偩偗偱側偔倣RNA僾儘僙僔儞僌偺惂屼偵傕娭梌偟偰偄傞偙偲偑暘偐傝傑偟偨丅傑偨丄NELF偲CBC偵傛傞僸僗僩儞倣RNA偺3乫枛抂僾儘僙僢僔儞僌偼丄嵶朎廃婜S婜偵偍偗傞僸僗僩儞倣RNA偲丄僸僗僩儞僞儞僷僋幙偺摿堎揑側検嶻偵廳梫側栶妱傪壥偨偟偰偄傞偙偲偑傢偐傝傑偟偨丅
乮俆乯僄僺僕僃僱僥傿僢僋惂屼傊偺娭梌
DSIF偲憡屳嶌梡偟偰Pol嘥嘥偺揮幨妶惈傪槾恑偡傞場巕偲偟偰Tat-SF1偲Paf侾暋崌懱傪尒弌偟傑偟偨乮Chen et al.,Genes
Dev.,2009乯丅DSIF偼Tat-SF1偲Paf1暋崌懱傪堚揱巕忋偵儕僋儖乕僩偡傞摥偒偑偁傝丄俁幰偑嫤挷揑偵Pol嘥嘥偲寢崌偟傑偡丅Paf1暋崌懱偼斾偡僩儞偺壔妛廋忺偺堦偮偱偁傞H2B偺K120偺儌僲儐價僉僠儞壔偵娭梌偟丄怢挿抜奒偵偍偗傞Pol嘥嘥偺妶惈壔偵娭傢傞偙偲傪柧傜偐偵偟偰偄傑偡丅
変乆偼丄懠偵僛僽儔僼傿僢僔儏傗儅僂僗側偳傪梡偄偨屌懱儗儀儖偺尋媶傕恑傔偰偍傝丄崅摍恀妀惗暔偵偍偗傞揮幨怢挿惂屼偺曪妵揑側棟夝傪栚巜偟偰偄傑偡丅
偙偺尋媶暘栰偼廬棃傎偲傫偳枹奐戱偱偁傝丄夁嫀侾侽擭偵傢偨偭偰変乆偑悽奅偵愭嬱偗偰撈帺偵愗傝戱偄偰偒傑偟偨丅崱屻傕偙偺揮幨奐巒偐傜廔寢偵帄傞傑偱偺DNA幉偵増偭偨Pol嘥嘥儂儘峺慺偺僟僀僫儈僢僋側儕儌僨儕儞僌偲偄偆尋媶僥乕儅傪怺偔孈傝壓偘偰偄偔偮傕傝偱偡丅
側偍丄嵟嬤偙偺尋媶摦岦傪暘偐傝傗偡偔徯夘偟偨彂愋偲偟偰丄乽揮幨偑傢偐傞乿乮敿揷岹曇丄梤搚幮丄俀侽侽俀擭乯丄乽揮幨尋媶廤拞儅僗僞乕乿乮敿揷岹丄榓揷撃拤巙丄嶳岥梇婸嫟曇丄梤搚幮丄俀侽侽俆擭乯傗乽揮幨場巕偵傛傞惗柦尰徾夝柧偺嵟慜慄乿乮嶳岥傜暘扴幏昅丄梤搚幮丄俀侽侽俈擭乯側偳偑偁傝傑偡丅