研究内容
詳細は各テーマをクリックしてください
1. 液液相分離と神経変性疾患
筋萎縮性側索硬化症(ALS)や前頭側頭葉型認知症などの神経変性疾患では、患者さんの脳内に封入体と呼ばれる蛋白の凝集体が観察されることが知られていましたが、どのようにしてこれらの凝集体が形成されるかは不明でした。近年、液液相分離(liquid-liquid phase separation: LLPS)と呼ばれる現象を介して、これらの凝集体が形成されることが報告され、注目を集めています。
液液相分離とは水溶液を混合すると溶質同士が多価的に結合することで液滴を水溶液内で形成し、あたかも水と油のように分離する現象です。多くのALS原因蛋白が液液相分離を起こすことが報告されており、さらに相分離を介して凝集体へ相転移(液体から固体へ状態が変化すること)することが明らかになったことから、相分離異常とALS発症との強い関連が示されつつあります。
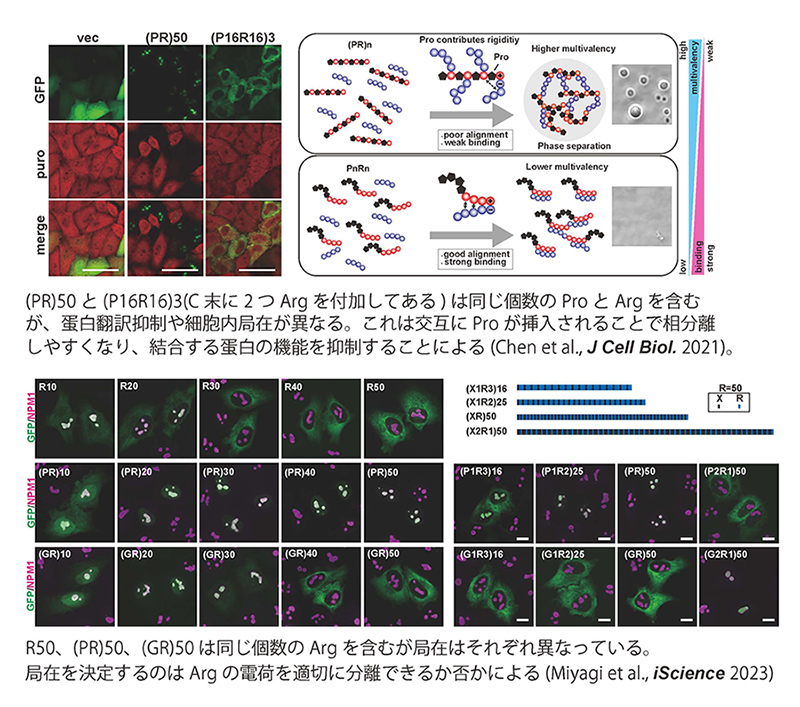
家族性ALSの最も高頻度な原因遺伝子であるC9ORF72から産生されるpoly(PR)およびpoly(GR)ペプチドは正電荷を強く帯びることから非常に他の分子と結合しやすく、実際に様々な分子と相分離し、毒性を発揮することが示されていますが、その分子機構は不明でした。我々は従来の分子生物学や生化学的手法に加え、最先端のproteomics技術とデータマイニング技術、また分子動力学計算を合わせることで、これらのジペプチドがどのように相分離を制御し、毒性を発揮しているのかを明らかにして来ました(Kanekura et al., Hum Mol Genet 2016; Kanekura et al., Sci Rep. 2018; Chen et al., J Cell Biol. 2021; Miyagi et al., iScience 2023他)。C9ORF72遺伝子異常は家族性ALSの40%、孤発性ALSの5-10%を占めると考えられており、C9ORF72関連ALSの病態解明はALS研究に大きく貢献できると考えています。
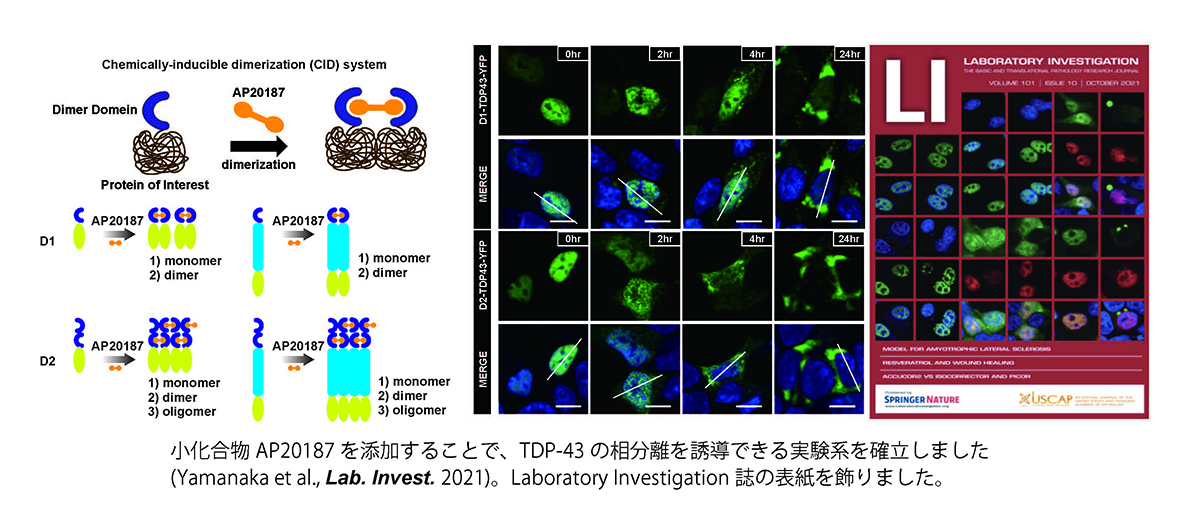
また、97%のALS患者では残存運動神経細胞においてTDP-43と呼ばれる蛋白質の凝集体が見られます。TDP-43自体も相分離しやすい蛋白であることが知られていますが、なぜ凝集体を形成するのかは不明でした。光遺伝学(Optogenetics)を用いた研究により、TDP-43の凝集体形成は液液相分離を介して相転移を起こすことで誘導されるとの研究がいくつかのグループから発表されていますが、いまだその機構は不明な点が多いです。我々は小化合物を用いてTDP-43の相分離を制御する技術を開発し、小化合物を添加することで核内から細胞質へTDP-43が局在を変え、ALSの患者さんで見られるような凝集体を誘導できることを確認しました(Yamanaka et al., Lab. Invest 2021; Kanekura et al., Neur. Regen. Res. 2022)。今後さらなる解析を行い、TDP-43の相分離異常とALS発症の関係を明らかにしたいと考えています。
2. 液液相分離と非膜性オルガネラ
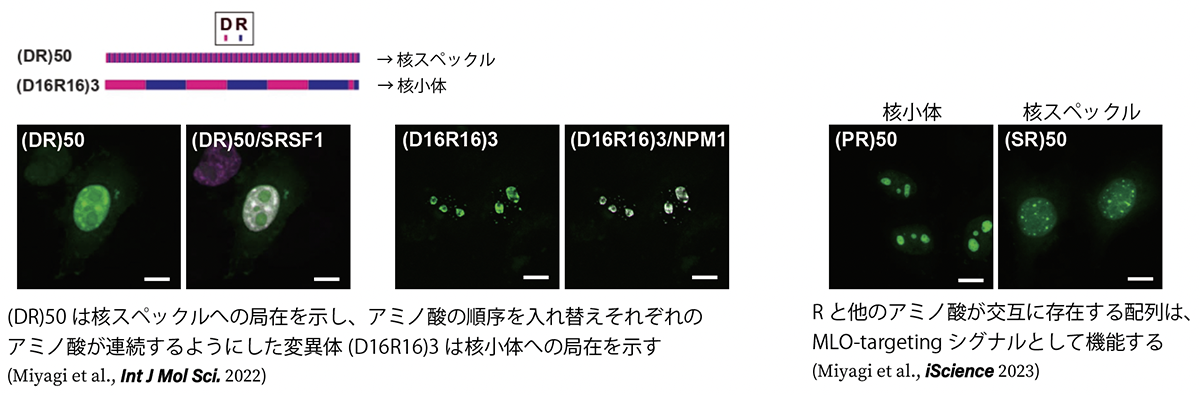
液液相分離はALSや他の神経変性疾患の発症に関与するだけでなく、細胞内においても様々な生理的機能に必須です。特に核小体などの非膜性オルガネラ(membrane-less organelle: MLO)と呼ばれる、従来の細胞内小器官の持つ脂質による隔離膜を持たないオルガネラの形成機構として特に注目を集めています。しかし、極めて高濃度の蛋白質や核酸などの高分子が存在する真核細胞内において、どのようにして特定の部位で特定の分子が相分離し、 MLOを形成するのか、その機構についてはほとんど分かっていません。我々は核スペックルと呼ばれるMLOの構成蛋白質群に特有の配列に着目しました。核スペックルに存在する蛋白には酸性アミノ酸であるグルタミン酸(D)やアスパラギン酸(E)と塩基性アミノ酸であるアルギニン(R)が交互に出現する配列が多いことが知られています(Greig et al., Mol Cell 2019)。我々はこれらの配列の変異体を多数作成し、その細胞内局在や相分離について解析することで、同じ数のDとRからなる配列でも並び方により局在するMLOが異なり、DとRを同じ数含む配列でも、DとRを混在させずそれぞれ分離させると核スペックルではなく核小体へ局在したことから、DとRが交互に存在することが核スペックルへの局在に必須であることを明らかにしました(Miyagi et al., Int J Mol Sci. 2022)。また、Rと他のアミノ酸が交互に存在する配列が内在性のMLO-targeting signalとして核小体や核スペックル、PML bodyへの局在化を制御することをhuman proteomeのデータマイニングにより明らかにしました(Miyagi et al., iScience 2023)。今後さらに特定のMLOへの局在機構やMLOの形成機構について明らかにしていきます。
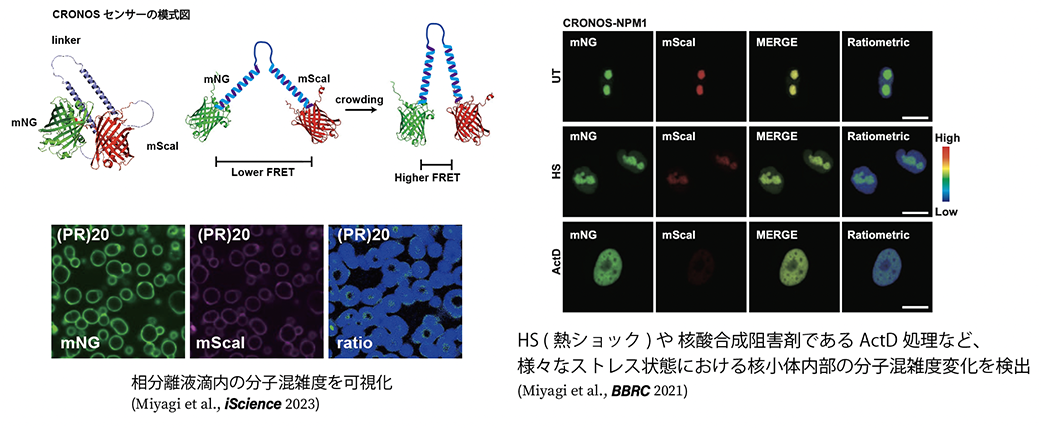
3. マクロ分子クラウディングの可視化と液液相分離
高分子が相分離を起こすには分子の混雑度が高いことが重要です。しかし、従来の手法では分子の混雑度を具体的に測定することは困難でした。2015年にFRETを基盤技術としたクラウディングセンサーが報告され(Boersma et al., Nat. Method. 2015)、様々なストレス下での細胞内のクラウディングの変化が測定されて来ましたが、センサーとしての感度が十分とは言えず、微細な変化の検出は困難でした。そこで我々は従来のFRETセンサーの構造を利用し、FRETのdonorとacceptorの蛍光蛋白のペアを最適化することで、従来のセンサーよりも圧倒的に高感度のセンサーCRONOS(crowding sensor with mNeonGreen and mScarlet-I)を開発した。CRONOSの利用により、これまで知られてこなかったストレス下でのMLO内部のクラウディング変化の検出が可能となり(Miyagi et al., BBRC 2021)、相分離液滴内の環境変化を可視化することが初めて可能となりました(Miyagi et al., iScience 2023)。今後生体内でのマクロ分子クラウディング測定にも応用し、生体内において高分子の混雑度合いがどのように制御され、変化していくのかを明らかにしたいと思います。この研究を進めていくことで、なぜ特定の細胞で蛋白が凝集するのか、特定の細胞で毒性が発揮されるのかといった疑問を明らかにできるのではないかと期待しています。
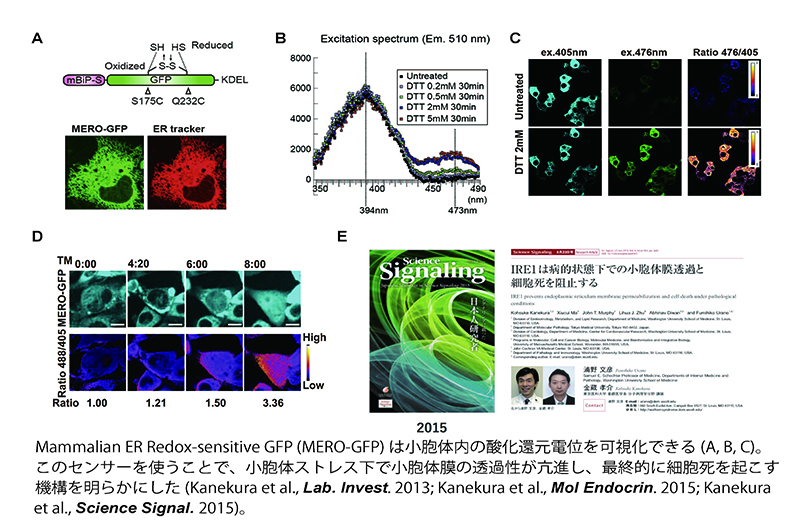
4. 小胞体ストレスと神経変性疾患
遺伝子変異が検出される家族性ALSと異なり、家族歴のない孤発性ALSの発症機構はほぼ不明です。しかし、孤発性ALS患者の神経組織内で小胞体ストレスと呼ばれる細胞内ストレスが誘導されていることが示されたことから(Saxena et al., Nat Neurosci. 2009)、我々は小胞体ストレスと神経細胞死の関係について研究を進めました。小胞体は細胞内にネットワーク上に広がっている細胞内小器官であり、膜蛋白質や分泌蛋白を合成する場である他、これらの蛋白への糖鎖付加、細胞内カルシウム貯蔵などにおいても重要な役割を果たしています。また、膜蛋白や分泌蛋白の構造的な剛性を付与するジスルフィド結合(-S-S-)を形成する場でもあるため、小胞体内は例外的に酸化的な条件が維持されています。我々は小胞体内の酸化還元電位を可視化するためのプローブMERO-GFP(mammalian ER redox-GFP)を開発し、小胞体ストレス下における小胞体内環境変化の観測を行いました(Kanekura et al., Lab. Invest. 2012)。その結果、小胞体ストレス下では小胞体膜の透過性が亢進することにより酸化還元電位が乱れ、その結果細胞死が誘導される新規機構を発見しました(Kanekura et al., Mol. Endocrin. 2015; Kanekura et al., Science Signaling 2015)。
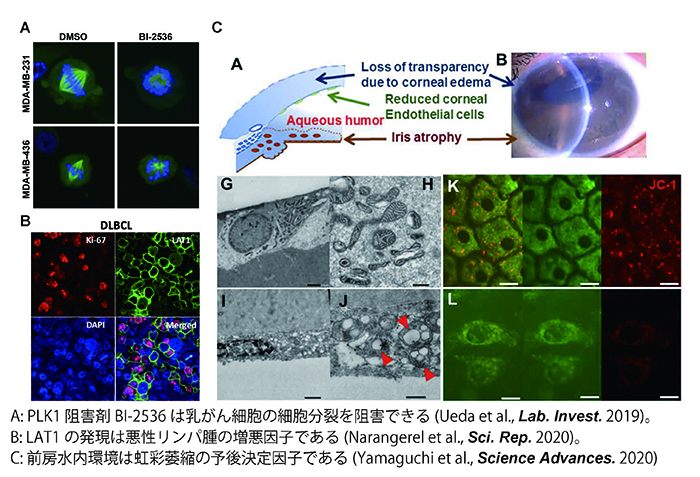
5. オミクス解析を駆使した疾患発症機構の解明
我々は様々な臨床科の先生方との共同研究も進めています。学位論文の指導として、東京医大乳腺科との共同研究でtriple negative breast cancer(TNBC)の増殖に必須の遺伝子PLK1をsiRNA screeningで同定し、その阻害剤がTNBC治療に使える可能性について報告しました(Ueda et al., Lab. Invest. 2019)。また東京医大血液内科との共同研究により、悪性リンパ腫の増殖に必須の遺伝子LAT1を同定し、その阻害剤が悪性リンパ腫の治療薬候補となりうることを報告しています(Jigjidkhorloo et al., Sci. Rep. 2021)。さらに、東京歯科大学眼科との共同研究では、虹彩萎縮の原因として前房水内環境が重要であることをマルチオミクス解析により、明らかにして来ました(Yamaguchi et al., Science Advances 2020)。今後も開かれた薬理学教室を目指し、臨床科の先生方との共同研究を進めて参ります。