3. ケミカルジェネティクス/ケミカルバイオロジー
ケミカルバイオロジーとは、一連の低分子化合物を用いて生体反応の制御機構やネットワークを研究する分野です。一連の化合物をバイオアッセイやスクリーニングにより評価して、化合物の構造活性相関が解明され、しかも化合物の標的タンパク質が同定され、それば関与する生体反応やネットワークが解明できれば、化合物の作用機構が理解できるし、新たな創薬ターゲットとなるタンパク質も同定され、それら情報は創薬にとって大変貴重なものとなります。従って、ケミカルバイオロジーにより得られる成果は、生命科学の基礎研究ばかりでなく、応用展開・実用化に極めて密接しており、国の内外を問わず大変脚光を浴びています。
また、ケミカルジェネティクスは、標的タンパク質の特定機能ドメインに結合して、その機能を阻害や活性化することによって制御する低分子化合物を用いて、特定タンパク質の特定ドメインの機能を研究する分野です。従来からタンパク質の機能を解析する方法として、遺伝学的方法であるDNAレベルでのノックアウト法や、mRNAレベルでのsiRNAなどによるノックダウン法が今日盛んに行われています。しかし、これらの方法では、遺伝子の発現を阻害するのでタンパク質は合成されず、遺伝子の持つ情報、すなわち機能が全て失われます。ところが、低分子化合物を用いれば、タンパク質は合成され、しかも、低分子化合物は特定ドメインと選択的に結合するので、そのドメインの特定機能だけが選択的に失われ、他のドメインは正常に機能するので、特定機能に焦点を絞ることができ、的確な解析・評価ができます。従って、ケミカルジェネティクスは従来の遺伝学を凌ぐ、イノベーティブな技術革新であると云えます。
このようなケミカルジェネティクス/ケミカルバイオロジーにより、薬剤や有害物質やアミノ酸などの低分子化合物が示す生理活性の分子メカニズムを解明することは、生命科学の基礎研究の発展に多大に貢献するばかりでなく、新たな創薬ターゲットの発見や、副作用の無い次世代薬剤の開発や、テーラーメイド医療の発展などが実現可能となり、人間社会への多大な貢献が期待されます。
我々がケミカルバイオロジーに足を踏み入れたのは、キナーゼ阻害剤であるアデノシン類似物質DRBによる転写反応の阻害メカニズムの研究を始めた1995年頃からのことです。そのきっかけとなったのは、我々が独自に開発したアフィニティ精製用の新規担体であるラテックス(SG)ビーズです。このSGビーズに転写因子ATF/CREB配列(特異塩基配列を含む2本鎖DNA)を固定化して、HeLa細胞核抽出液と混合して、ワンステップでDNA結合性因子をアフィニティ精製した結果、同じ塩基配列を認識・結合するATF/CREBファミリーに属する8種類の全てのメンバーが一挙に単離されました。さらに、驚いたことに、それら転写因子メンバーと共に、DNAには結合しないキナーゼ活性が同時に単離されることを見出しました。そこで、我々はDNA結合性転写因子がキナーゼ活性をプロモータ上にリクルートすると考え、それならばこのキナーゼ活性は転写反応に何らかの影響を与えるのではないかと推測しました。それを検討する手っ取り早い方法として、キナーゼ活性の阻害剤を思い付き、探索しました。幸運にも、約60年前に抗ウイルス剤として開発され、その当時まで転写伸長反応を抑制するキナーゼ阻害剤として有名であったDRBが、このキナーゼ活性を見事に阻害することを見出しました。当時、DRBの作用メカニズムは未だ解明されておらず、世界の第一線級の転写研究者がこぞって、その作用メカニズムに大変関心を持っており、ひそかに研究を進めていました。そのような研究背景の下に、我々もDRBの転写阻害メカニズムの解析をin
vitro転写系とその再構成系を用いて行いました。その結果、見事にDRBによるRNAポリメラーゼⅡの転写伸長反応の阻害メカニズムを世界で最初に解き明かすことに成功しました。また、その阻害反応に関与する二つの新規タンパク質性因子(DSIFおよびNELF)を単離・同定することに成功し、それら因子の機能を明らかにしました。これら研究成果は、国際的に極めて高い評価を受けており、最も優れた分子生物学の教科書である米国の"Molecular Cell Biology"に、DSIFおよびNELFの両方共に取り上げられています。
このキナーゼ阻害剤DRBの研究経験から、低分子化合物を用いて複雑な生体反応の制御機構やネットワークを解明することは、今後生命科学の主流になると思ったので、その研究に必要となるであろう技術として低分子化合物を固定化したアフィニティ・ラテックスビーズによる精製システムを確立し、近年、それより優れた機能・性能を発揮するアフィニティ磁性ビーズを開発することに成功しました。最近では、このナノ磁性ビーズに多様な機能を付与して、医療・バイオ分野に応用展開できるまでになっています。これらの詳細に関しては、「2.高機能性ナノ磁性ビーズ」で詳しく紹介しているので、ご参照下さい。
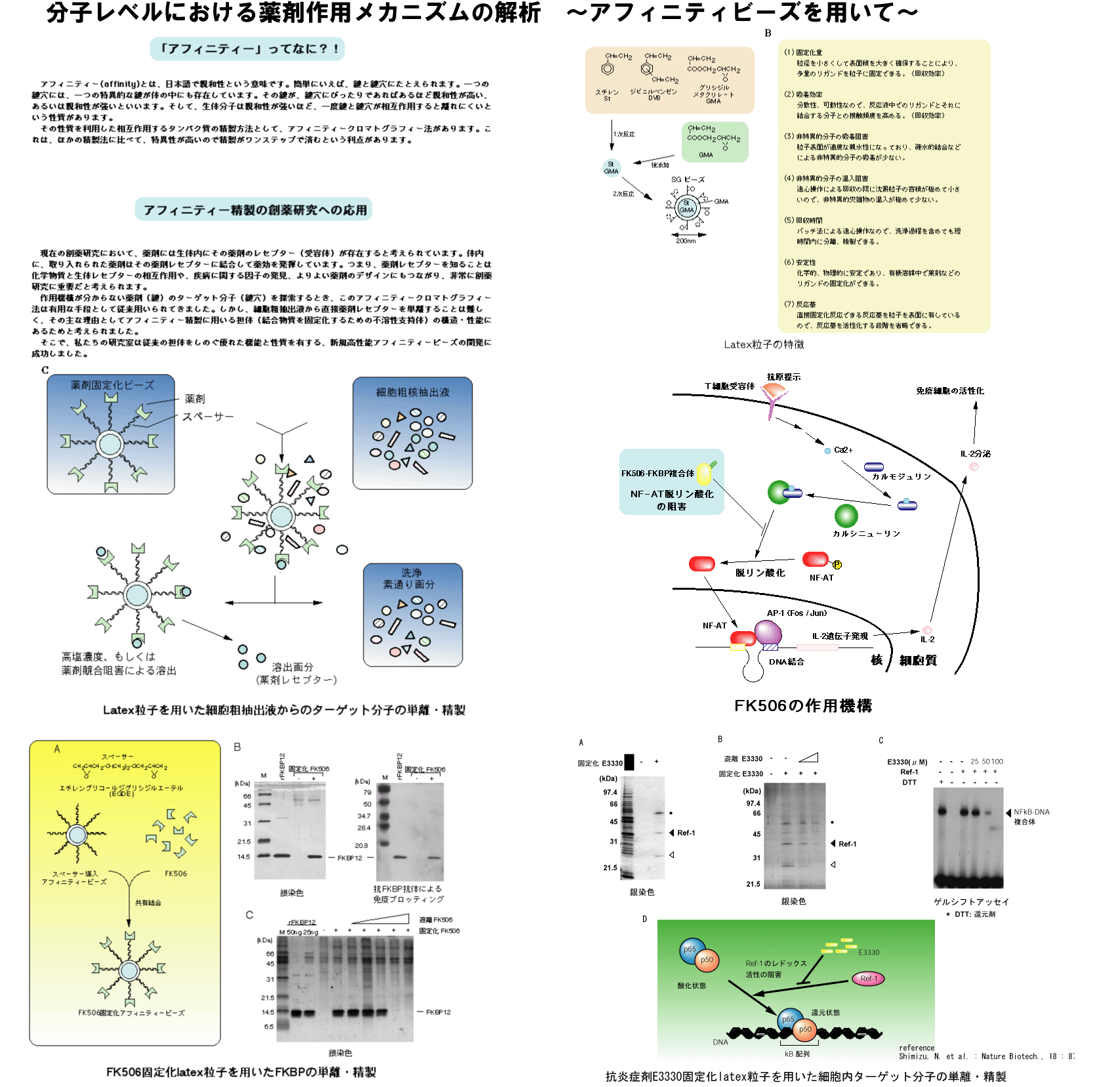
ケミカルバイオロジーにおいて、最も重要なポイントとなるのが、低分子化合物の標的となり、作用と関連するタンパク質を如何に的確かつ簡便に単離・同定するかということです。我々はこれまでに、アフィニティ精製用担体として高機能性ナノビーズを開発し、低分子化合物のビーズ上への固定化技術および細胞抽出液などのたんぱく質ライブラリーから目的とする物質をワンステップで精製できる技術を確立してきました(半田 宏、川口春馬共著、ナノアフィニティビーズのすべて、中山書店;Hiramoto
et al., Methods Enzymol., 2002 )。 この精製システムを用いて、我々はこれまでに、免疫抑制剤、キナーゼ阻害剤、抗炎症剤、抗糖尿病薬などの標的タンパク質を単離・同定し、標的タンパク質が関わる生体反応の制御メカニズムや制御ネットワークを解析しています (Shimizu
et al., Nat Biiotechnol., 2000; Tomohiro et al., Bioconjug Chem., 2002;
Nishi et al.,J.Biiol.,Chem., 2002; Shima et al., Genes Cells, 2003; Hatori
et al.,J Antibiot., 2004; Kusunoki et al., J. Pharmcol. Exp., 2005; Kabe
et al.,Antioxid. Redox. Signal., 2005)。
また、それら以外の多彩な薬剤(抗がん剤、抗炎症剤、抗リウマチ剤、骨粗鬆剤、糖尿病薬、鎮痛薬、免疫抑制剤など)や環境ホルモン、また、食品関連としてアミノ酸やビタミン、さらに、多彩な応用展開が期待されるポルフィリン/ヘムなどに対する生体内の標的タンパク質を単離・同定し、そられの作用メカニズムを標的タンパク質を基にして解析しています(kabe
et al.,J. Biol. Chem., 2006; Uga et al., Mol. Pharmacol., 2006; Saito et
al., J. Biiol.Chem.,2007; Yoshida et al., Mol.Pharm.,2008;Hase et at al.,
Biochem.Biophys. Res. Commun.,2008; Azuma et al., PLos ONE. 2008; Kume
et al., Genes Cells, 2010 )。標的タンパク質が同定されると、その関連の生体反応の制御メカニズムや制御ネットワークが理解でき、生命科学における基礎研究に大変役立っており、上記化合物に関する我々の研究成果をこれから徐々に公表していく予定です。
また、AAVウイルスタンパク質や病原性細菌O157や病原性赤痢菌の毒素生タンパク質などの標的タンパク質も同様の手法で単離・同定できており、それらの相互作用による標的タンパク質の機能変換を解析し、ウイルスタンパク質の遺伝子組み換え技術への応用展開や、細菌毒素を標的とした診断・予防・治療薬の開発などに役立つ情報が得られています(Han et al., Virology.,2004; Yamamoto et al., J. Virol., 2007; Iizumi et al., Cell Host & Microbe., 2007)。
さらに、標的タンパク質の低分子化合物との相互作用や生理作用などの情報を基盤として、創薬に向けた応用展開や実用化を目指して研究を行っています。その一環として、標的となるタンパク質やその機能ドメインを指標として、これに選択的に結合する新規薬剤を化合物ライブラリーである放線菌培養液からのスクリーニングするシステムを開発しています(Ohtsu
et al., Anal Biochem., 2005)。また、企業との産学連携研究を積極的に行うとともに、有機合成化学や情報工学などとの学際性に富んだ異分野連携融合研究を行い、副作用の無い次世代薬剤やテーラーメイド医療の開発を目指しています(Zenkoh
et al., Org Lett., 2004)。
近年、我々が開発したFGビーズを用いて、標的因子が既にわかっている抗がん剤MTXと骨粗しょう薬アレンドロネートの新規標的タンパク質としてdCKとダイナミンをそれぞれ単離・同定しました(Uga
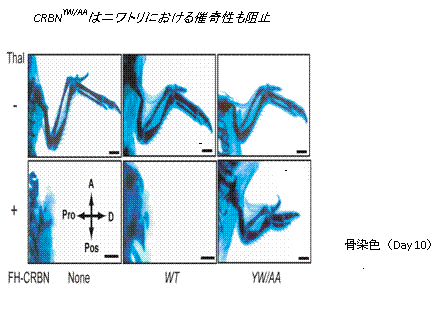
et al., Mol. Pharmacol., 2006; Masaike et al., Mol. Pharmacol., 2010)。これはFGビーズが極めて優れていることを証明するばかりでなく、新規標的タンパク質を介しての作用機構も解明しております。最近、FGビーズを用いて、催奇性で一時は市場から撤退したにもかかわらず、抗がん剤で市場に舞い戻った極めて稀有な薬剤サリドマイドの一つの結合タンパク質がセレブロンであることを見出し、セレブロンが催奇性の原因因子であることを証明しました(Ito
et al., Science, 2010)。この論文は非常にインパクトが強く、世界中のマスコミで大々的に取り上げらました。さらに、セレブロンがサリドマイドの主作用である抗がん作用にも関わることが米国Mayo
Clinicの研究グループにより発表され、セレブロンがより脚光を浴びています。これにより、米国の製薬企業との共同研究が始まり、米国企業が私の為に共同研究講座を東工大に設置してくれる運びとなりました。この研究はさらに面白く発展しています。
今年から、新学術領域研究「天然物ケミカルバイオロジー」の一つの研究班の班長を務めることになり、天然物化合物の中でも、特に、マクロライドの抗炎症作用に関わる標的タンパク質を北里大学北里生命科学研究所の大村智先生や砂塚敏明先生と共同で解析しています。
現在、抗炎症剤、糖尿病薬、抗がん剤などの標的タンパク質の探索と標的タンパク質が関わる生体反応の制御機構やネットワークやシグナル伝達関連の研究を国内外の研究機関と共同で推進しており、新規薬剤開発を目指しています。
ケミカルバイオロジーに関しては、その概要や最新情報や動向をまとめた書籍が、半田宏執筆・編集により「ケミカルバイオロジー・ケミカルゲノミクス」として2005年にシュプリンガー・フェアラーク東京から出版されています。また最近の総説として、加部泰明他,「蛋白質核酸酵素」,
52, 1637 (2007);坂本聡他「化学と生物」, 45, 712 (2007)などもありますので、ご一読下されば幸いです。