4. バイオナノカプセルの構築と応用
我々は、ウイルス粒子の外殻(カプシド)を構成するウイルス外殻タンパク質に興味を持ち、独自の基礎研究とその成果に基づいた応用研究を展開してきた。その結果、これまで開発してきたいくつかの技術やノウハウを基盤にして、遺伝子治療用の核酸や治療用の薬剤や生理活性物質を標的細胞に的確かつ高効率に運び込むための新規ドラッグデリバリーシステム(DDS)用ナノカプセルや、ワクチン製剤としての高機能性ナノカプセルを作製する技術を確立することができた。現在は、さらに実用化・製品化に向けた高機能化を図っており、産学あるいは産学官の連携研究を企業や大学医学部・病院の研究グループと共に展開している。そこで、我々がこれまで独自に開発してきたユニークないくつかの技術と、その技術を集約して作製した高機能性ナノカプセルの医療への応用展開を紹介する。
4-1.ウイルス外殻タンパク質の特長
ウイルスは元来有害なものであり、時としてヒトの生命を脅かす恐ろしい生き物でもあるが、近年のウイルス工学や分子生物学などの飛躍的な進歩により、ヒトに有益なものとして利用することが可能になった。その代表的なものが、遺伝子治療用の組換えウイルスベクターと、タンパク質多量合成用のバキュロウイルス発現系が挙げられる。これらの傑出した特長は、感染性ウイルスの持つ宿主細胞への選択的な指向性と極めて高い遺伝子導入効率である。ウイルスの持つこれらの特長によって、遺伝子治療が可能となり、また組換えタンパク質を培養細胞から多量に調製することが可能になり、人工合成キャリアでは不可能な蚕の蛹といった個体レベルでの感染による遺伝子導入とタンパク質の多量生産が可能になっている。
しかし、ウイルスベクターのいくつかはヒトに感染し、体内の宿主細胞で増殖し、生命を脅かす病原性ウイルスに由来していることから、その欠点としては、非病原性のウイルスベクターを作製しても、感染細胞中で増殖している間に遺伝子が変異し、生命を脅かす病原性を再び獲得する可能性がある。また、ウイルスが持つ抗原性や免疫原性によって、反復投与は禁忌で、しかも投与後のアレルギーやアナフラキシーショックの危険性がある。その解決策としてウイルスベクターに代わる人工担体(キャリア)の開発が盛んに行われており、カチオン性脂質(例:lipofectinTM試薬)やカチオン性ポリマー(例:polyethyleneimine)、 多糖(例:DEAE‐dextran)、セラミック材料(例:リン酸カルシウム)などが、DNAや薬剤を標的細胞内に導入するためのキャリアとして開発された。ところが、これらの人工キャリアは現状ではいずれもウイルスベクターによる導入効率とは比べ物にならないほど低く劣っており、さらに生体内では不安定でしかも凝集し易いという欠点を持つために、実用化までに到達するには長い年月が必要である。そこで、我々は、ウイルスコンポーネントの一つである粒子外側を構成するウイルス外殻タンパク質のみをキャリアとして使用することで、ウイルスの持つ欠点を解消し、有益な点だけをうまく活用することを考えた。
ここに、ウイルス粒子の生活環におけるウイルス外殻タンパク質が関わる役割りと、その際に発揮される優れた機能のいくつかを列挙する。
1. 宿主細胞の細胞膜受容体との選択的な結合(細胞識別・認識能)
2. 結合後のエンドサイトシースを介する細胞内侵入(細胞内への物質輸送能)
3. 細胞内の核など特定部位への移動(特定部位への移行能)
4. 特定部位における粒子からゲノムの放出(ゲノムの放出能)
5. 自己組織化によるウイルス粒子の形成(自己組織化能)
6. ウイルス粒子中へのゲノム(ミニクロマチン)の内包(ゲノムの包含能)
7. 細胞外でのゲノムの保護(ゲノムの保護能)
4-2. Simian virus 40(SV40)粒子の構造とコンポーネント
SV40は粒子径が約45nmの最も小さなウイルスである。ウイルス粒子はメジャー外殻タンパク質VP1と呼ばれる単一なタンパク質のみで構成され、VP1五量体が最小の構成単位となっている。その内側はマイナー外殻タンパク質VP2/VP3で裏打ちされており、その中に2本鎖環状DNAから成るウイルスゲノムとヒストンタンパク質から成るミニクロマチンが内包されている。SV40粒子は正二十面体構造で、その表面は12個の頂点と20個の三角形の面から成る。表面を構成するのは一種類のVP1で、通常は、VP1が5個集合したVP1五量体(ペンタマー)を形成し、粒子の基本単位となっている。各頂点と面は、それぞれ1個と3個のVP1五量体により構成され、頂点および面のVP1五量体はそれぞれ1個のVP2およびVP3により裏打ちされています。従って、ウイルス粒子は72個のVP1五量体とそれを裏打ちする12個のVP2と60個のVP3から構成されている。
VP2とVP3は同じ前駆体mRNAから派生するsplice variantsにコードされ、それぞれのタンパク質は352個と234個のアミノ酸から成る。VP2はN末側に118個の固有のアミノ酸を有し、残り234個はVP3と全く同じアミノ酸配列を共有する。
SV40ゲノムは正確には5,243塩基対の環状2本鎖(ds)DNAから成っており、核内や粒子内ではSV40ゲノムは約21個のヒストン8量体に巻き付き、直径約30nmの環状構造をしたミニクロマチンを形成する。SV40の粒子形成過程でヒストンH1は、一旦はゲノムと結合するが、最終的には取り除かれ、粒子中には取り込まれない。従って、感染性SV40粒子中には、ヒストンタンパク質のH1以外のH2A、H2B、H3、H4が含まれている。SV40粒子は感染細胞の核内で形成されるので、粒子形成の際は核内に多量存在する宿主細胞ゲノムからSV40ゲノムを選別し、粒子中に内包する機構があると考えられる。SV40粒子の外殻を構成するVP1, VP2, VP3はいずれもdsDNAと非特異的結合能を持つが、特異的な塩基配列の認識能はない。また、SV40ゲノムにはsesと呼ばれる配列が存在し、宿主細胞の転写因子Sp1がses配列と結合し、Sp1と相互作用するVP2がVP1五量体をリクル−トし、VP1五量体がSV40ゲノムを選択的に包むことが示唆されている。但し、SV40粒子中にはSp1は含まれないので、このモデルではSp1は粒子形成過程のどこかで取り除かれる必要がある。また、SV40ゲノムを巻き付くヒストン8量体は高度にアセチル化されていることから、アセチル化がSV40ゲノムのVP1五量体による選択的な包含に関わるという報告もある。しかし、いずれのモデルも未だ確証はなく、SV40ゲノムがウイルス粒子中に如何にして内包されるかは明確にされていない。我々は、VP2/VP3がウイルスゲノムの細胞核内への移行に関与することを示している(Nakanishi et al., J. Virol., 2007)。
4-3.SV40外殻タンパク質VP1
SV40粒子はウイルスとして最も小さくしかも単純な構造をしているので古くから最もよく研究が行われ、X線構造解析や全ゲノム配列決定が一番早くから為された。粒子の外側はVP1と呼ばれる外殻タンパク質のみで構成されている。また、SV40は1950年代の後半に多くのヒトに接種されたポリオワクチンの中に混在していたが、それが原因でがんや疾病が引き起こされたという報告はなく、これまでのウイルス学的や疫学的な研究からもヒトに対して非病原性のウイルスであると考えられている。
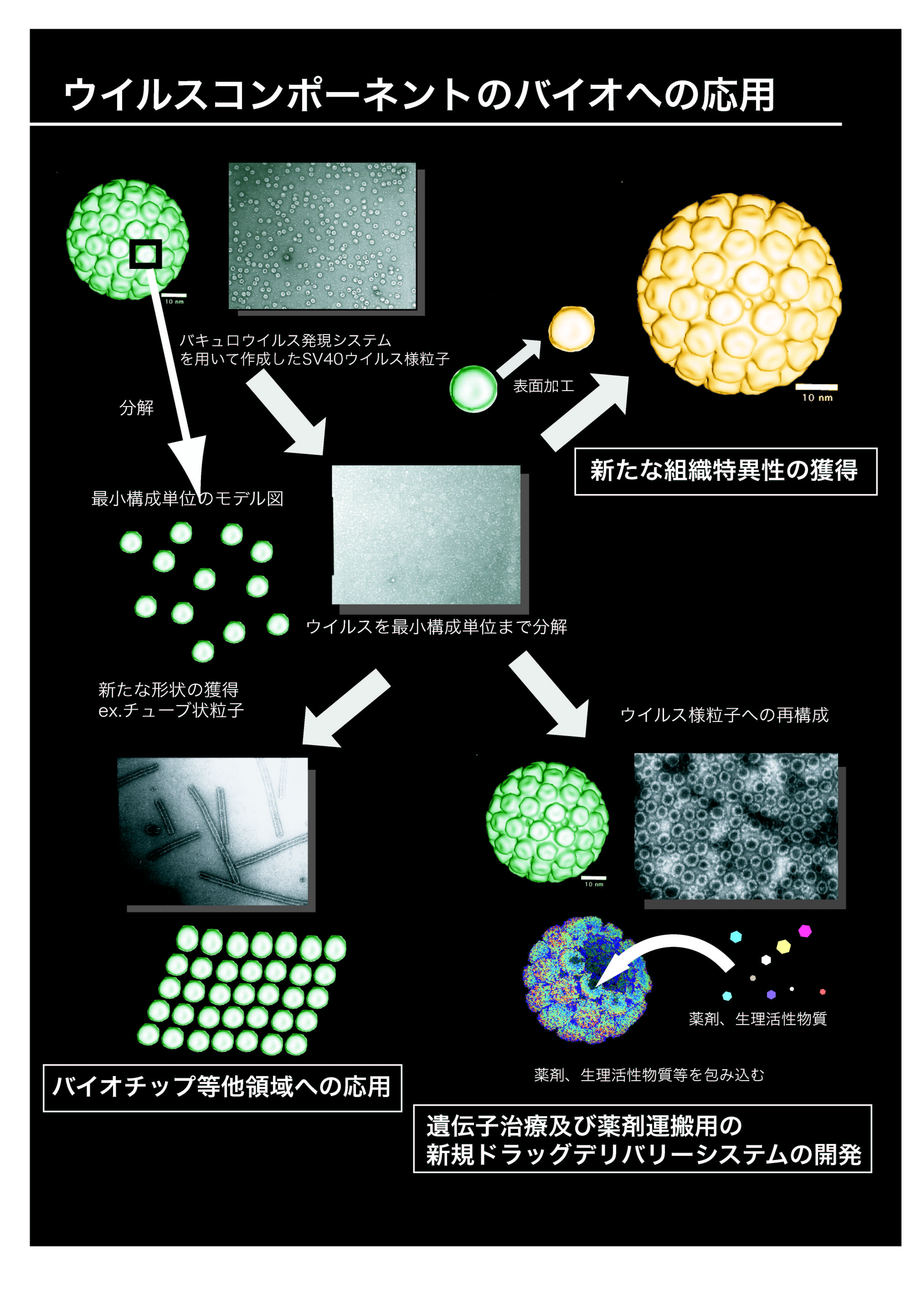
そこで、SV40のウイルス外殻タンパク質VP1を研究材料として選び、まず、VP1を高発現する組換えバキュロウイルスを作製した。次に、組換えバキュロウイルスを昆虫細胞に感染させ、感染細胞の核内でVP1遺伝子を高発現させると、細胞質で多量に合成された組換えVP1が核に移行し、核内でVP1五量体が自己組織化して沢山のウイルス様構造体(Virus-like particle: VLP)が形成されることがわかった。そこで、我々は感染細胞を破壊し、核からVLPを高効率に回収する方法を確立した(Kosukegawa et al., Biochim. Biophys. Acta., 1996)。回収したVLPは、野生型SV40粒子と同様の構造および表面性状を有し、還元剤DTTとカルシウムキレート剤EGTAで同時に処理すると、ウイルス粒子を構成する最小単位であるVP1五量体にまで解離できる。さらに、この解離したVP1五量体をゲルろ過法を用いて分画することで高純度に精製することができた(Ishizu et al., J. Virol., 2001)。この結果から、VP1五量体によるVLP形成には、カルシウムイオンとS-S結合が必要であることが示唆された。そこで、カルシウムイオンとの結合やS-S結合に関わるVP1のアミノ酸をいくつか決定した。また、VP1とカルシウムイオンとの結合はin vitro系のVLP形成だけでなく、in vivo系の感染細胞内におけるSV40粒子の分解にも関与することがわかった(Kawano et al., J. Biol. Chem., 2009)
4-4. VP1五量体の自己組織化によるナノ構造体の形成
さらに、一旦解離したVP1五量体を透析法で溶液置換すると、自己組織化が起こり再びナノ構造体が形成されることがわかった(Kanesashi et al., J. Gen. Virol., 2003)。例えば、透析溶液が1M NaClと2mM CaCl2を含む高塩濃度条件下では、VP1五量体は自己組織化し、粒径が20nm、32nm、45nmといった異なるサイズのVLPに似た形状のナノカプセルと、チューブ状構造体が形成される。ところが、CaCl2を含まず1M NaClのみを含む透析溶液では、粒径20nmの均一なナノカプセルが形成される。また、2M (NH4)2SO4と2mM CaCl2を含む溶液で透析すると、野生型SV40と同じサイズである粒径45nmの球状なナノカプセルが形成される。さらに、水素イオン指数であるpHが9.0〜10.0といったアルカリ性条件下では、いびつ(歪)な粒子様構造体が形成されるが、pH5.0という酸性条件下ではチューブ状構造体のみが選択的に形成される。結果として、VP1五量体は高塩濃度や高および低pHといった非生理的条件下では何らかのナノ構造体を形成するが、生理的条件下(150mM NaCl、pH7.2)では、VP1五量体はナノ構造体を形成することなく、そのままの状態を維持することがわかった。
4-5. ナノカプセル形成を誘導する因子
4-5-1. マイナー外殻タンパク質VP2/VP3
生理的条件下ではVP1五量体はナノ構造体を形成しないことがわかったので、生理的条件下でVP1五量体によるナノ構造体形成を引き起こす因子の探索に取り掛かった。候補因子としてVP1五量体の裏打ちタンパク質が頭に浮かんだ。というのは、ウイルス粒子外殻は72個のVP1五量体から成り、各五量体に1個のVP2またはVP3が裏打ちタンパク質として結合しているので、VP2/VP3の結合によりVP1五量体の自己組織化が誘導される可能性があると考えた
そこで、組換えVP2の共存在下でVP1五量体を上記のpH5.0酸性溶液で透析すると、チューブ状構造体は全く形成されず、粒径45nmの球状ナノカプセルが形成され、しかもその中にVP2が内包されることが確認された。さらに、生理的条件下(150mM NaCl、pH7.2)で透析しても、VP2添加により、VP2を中に含む球状ナノカプセルが形成された。その後、352個のアミノ酸から成るVP2中でナノカプセル形成誘導に必要な領域は119-272領域であることを見出した(Kawano et al., J. Biol. Chem., 2006)。これはVP2とVP3に共通した領域でin vitro系においてVP1五量体の自己組織化を誘発し、ナノカプセル形成を誘導することがわかった。この生理的条件下かつ高度精製系において、VP1五量体のナノカプセル形成に成功したのは世界ではじめてのことです。
この結果から、VP2またはVP3と外来タンパク質との融合タンパク質は、ナノカプセル中に内包され、感染により宿主細胞内に導入されるのではと推測した。そこで、VP2と蛍光タンパク質GFPとの融合タンパク質や、VP2と酵素シトシン・デアミナーゼとの融合タンパク質を発現するプラスミドを作製し、それをバキュロウイルスゲノムに組み込んだ組換えベキュロウイルスを作製した。VP2融合タンパク質をナノカプセル中に包含するために、我々は上記のin vitro系に加えて、VP1発現バキュロウイルスとVP2融合タンパク質発現バキュロウイルスの昆虫細胞への混合感染によるin vivo系を開発した。面白いことに、in vivo系でナノカプセル中に外来タンパク質の内包に関与するのはin vitro系とは異なっており、VP2の273-308領域であることがわかり、また、2つの組換えバキュロウイルスを昆虫細胞に混合感染させ、VP2融合タンパク質を内包したVP1五量体から成るナノカプセルを産生する技術開発にも成功した。これにより、in vitro系でもin vivo系でも組換えVP2融合タンパク質を内包したVP1五量体から構成されるナノカプセルを産生することが可能になった。
次に、これらナノカプセルを宿主細胞に感染させ、融合タンパク質が細胞内に導入され、細胞内における機能発現を蛍光検出や酵素活性により評価した。その結果、in vitro系およびin vivo系で形成されたナノカプセルは、いずれも野生SV40と同様に宿主細胞に感染し、VP2融合GFPが細胞内へ導入されることが、細胞内で発せられる蛍光として鮮明に確認された。また、細胞内に導入されたVP2融合シトシン・デアミナーゼは、酵素活性を発揮し、培地中に添加されたプロドラッグ型5-FCをドラッグ型5-FUに効率よく変換し、非感染のコントロール細胞群と比較すると、変換された5-FUによる細胞死が有意に起こることがわかった。これらの結果から、確かにVP1五量体から成るナノカプセルによって、蛍光GFPや酵素シトシン・デアミナーゼが細胞内に導入され、それぞれの活性が発揮されることがわかった(Inoue et al., J. Biotechnol., 2008)。これにより、遺伝子DNAを介してタンパク質を細胞内で発現させるのではなく、機能性タンパク質をじかに細胞内に導入するシステムが開発された。但し、この場合、細胞内に導入されたタンパク質の寿命・安定性が機能発現に重要な鍵となるので、その制御系の開発が今後の課題である。
4-5-2. 二本鎖DNA(dsDNA)
さて、外殻タンパク質VP1五量体の内側にはdsDNAと相互作用するプラス荷電の領域があることから、次に、dsDNAを球状ナノカプセルの形成誘導因子として選択した。まず、負の超らせん構造を持つ約5,000塩基対の環状二本鎖プラスミドDNAを大腸菌で調製した。このdsDNAをVP1五量体を含む150mM NaCl、2mM CaCl2、20mMTris-HClの生理的な緩衝液(pH7.0)に添加すると、粒径45nmのVLP様の球状ナノカプセルが見事に形成された。興味あることに、環状dsDNAである必要はなく直鎖状dsDNAであっても球状ナノカプセルは同じ様に形成される(Tsukamoto et al., Genes Cells, 2007)。dsDNAを添加しないと、VP1五量体はそのままの状態で留まることから、VP1五量体がdsDNAと相互作用することで、自己組織化が誘導されて球状ナノカプセルが形成されると思われる。
dsDNAを添加した状態で反応液中の塩濃度を高めると、塩濃度が高くなるにつれてVP1五量体によるナノカプセル形成は阻害され、VP1五量体単独の場合と区別がつかなくなる。例えば、1M NaClと2mM CaCl2を含んだトリス緩衝液(pH7.0)の条件下ではdsDNA存在の有無に関わらず、サイズが20nmや30nmの球状構造体と45nmの球状構造体とチューブ状構造体が形成される。これは、高塩濃度条件下では、VP1五量体とdsDNAとの間の相互作用がうまく起こらず、VP1五量体同士による自己組織化が優先的に起こるためと考えられる。
また、Ca2+がdsDNA添加による球状ナノカプセル形成に及ぼす影響を調べるために、CaCl2濃度効果を検討した。CaCl2が低濃度の場合では、VP1五量体はチューブ状構造体を優先的に形成し、球状ナノカプセルを含む球状構造体の形成効率は極めて低い。これは、生理的条件下におけるdsDNAの球状ナノカプセル形成誘導にはCa2+の必要性が示された。
マイナ−カプシドタンパク質の場合と同様に、dsDNA添加によるナノカプセル形成へのpHの影響を調べてみると、pH5.0からpH9.0の間ではナノカプセルは形成される。特に、VP1五量体単独ではチューブ状構造体が形成されるpH5.0の場合でも、dsDNAを添加するとチューブ状構造体ではなく、球状ナノカプセルが形成される。従って、dsDNAはVP1五量体との相互作用を介して、VP1五量体による球状ナノカプセル形成を誘導すると考えられる。
次に、形成されるナノカプセルの中にdsDNAが包含されているかを調べた。まず、GFP遺伝子とSV40複製開始点(ori)を持つ約5,000塩基対の発現プラスミドDNAを作製した。このdsDNAとVP1五量体とを生理的条件下で混合すると、球状ナノカプセルが形成される。形成されたナノカプセルをCOS1細胞(猿腎由来のCV1細胞をSV40T抗原で形質転換した細胞)に感染させるとGFP陽性細胞が観察された。この結果は、組換えDNAはナノカプセル中に内包され、感染により宿主細胞内に導入され、核内移行し、GFP遺伝子が発現されることを示したが、GFP陽性細胞数は非常に少なく、ナノカプセルを介しての感染・発現効率が極めて低いことがわかった。
そこで、感染・発現効率が低い原因を調べるために、dsDNA添加によって形成されるナノカプセル中に内包されるDNAの長さを検討した。まず、ナノカプセル中に内包する5,000塩基対のプラスミドDNAは、10塩基対が約3.4nmとして概算すると約1,700 nmとなる。このサイズでは粒径45nmのナノカプセル中に内包することは、直鎖状DNAではまず無理で、超ラセン構造であっても難しいと思える。実際に、2,000~10,000塩基対の間の異なるサイズのDNAで形成されるナノカプセルをDNA分解酵素DNaseで処理すると、カプセル内のDNAは切断を免れると考え、DNase耐性のDNAサイズを解析した。その結果、直鎖状でも超ラセン状でも約2,000塩基対のDNAが切断を免れ、それ以下の場合は全く切断されなかった。これは、ナノカプセル中に内包されるdsDNAは最大2,000塩基対で、それより大きなサイズの部分はナノカプセルの外に露出しており、培地中や細胞内に存在するDNaseによって容易に切断され、それが感染効率を著しく低下する原因の一つと考えられる(Tsukamoto et al., Genes Cells, 2007)。
dsDNAがVP1五量体による球状ナノカプセル形成を誘導する仕様として、(1)dsDNAがVP1五量体と相互作用し、VP1五量体の構造変化を誘導する、(2)dsDNAがVP1五量体間の連結を促進するための足場となる、が考えられる。前者が主であれば、dsDNAのサイズは球状ナノカプセル形成にあまり影響を及ぼさないであろう。ところが後者が主であれば、dsDNAが短い場合には、VP1五量体の必要な数が結合できずに、ナノカプセル形成が起こらないと考えられる。そこで、生理的条件下で、一定濃度のVP1五量体を含む溶液中に、サイズの異なるdsDNAを添加した。750塩基対から10,000塩基対の間のサイズの異なるdsDNAを添加すると、直鎖状であっても環状超らせん状であっても45nmの球状ナノカプセルが形成される。ところが、750塩基対以下の50塩基対や250塩基対では45nmの球状ナノカプセルは形成されなく、サイズが小さい20nmの球状ナノカプセルが形成される。また、一定濃度のVP1五量体に、約5,000塩基対のDNAを過剰添加すると、濃度上昇に伴って主に20nmの小さな球状構造体が形成される。VP1五量体による45nmのナノカプセル形成には、dsDNAのサイズは少なくとも750塩基対は必要で、それ以下だと20nmの小さな球状構造体が形成される。また、添加するdsDNA量もナノカプセルのサイズを決める重要な要因となっている。以上の結果から、dsDNAはVP1五量体と相互作用し、その局所濃度を上昇し、VP1五量体間の連結を亢進する足場となっていると考えられる。
我々は、DNAである必要は無く、RNAであっても、例えば、リボソームRNA(rRNA)のようなサイズの大きなものであれば、十分にナノカプセル形成誘導能を持つことを見出している。
4-5-3. ミニクロマチン
dsDNAは球状ナノカプセル形成を誘導するが、ナノカプセル中に内包されるdsDNAのサイズが大幅に制限されることがわかった。それを解決するために、我々は裸(naked)のdsDNAではなく、ミニクロマチン構造にすればdsDNAをコンパクト化でき、大きなサイズのdsDNAをナノカプセル中に内包できるのではないかと考えた。そこで、試験管内で高塩濃度条件下でdsDNAと4種類のヒストンタンパク質を混合し、透析により徐々に塩濃度を下げることで人工的なミニクロマチンを形成させ、それがVP1五量体による球状ナノカプセル形成を誘導できるかを調べた。その結果、ミニクロマチンでも球状ナノカプセル形成を誘導することができ、ナノカプセルの中に約5,000塩基対の環状閉鎖dsDNAを含むミニクロマチンを内包し、その感染により宿主細胞に外来遺伝子を運び込み、発現させる効率を飛躍的に高めることに成功した(Enomoto et al., Virology, 2011)。
また、SV40粒子中のヒストンは、高度にアセチル化されていることが報告されており、これが感染効率を高める要因となっている可能性も考えられる。そこで、高アセチル化ヒストンを調製し、それを用いてミニクロマチンを調製した。最終的に、本来の感染性SV40粒子に類似させるために、高アセチル化ヒストンと共にVP2とVP3を含む球状ナノカプセルを作製することができた。その最終品の感染効率を、これまでの作製途上のナノカプセルと比較検討した。すると、感染効率も大幅にアップし、本来の感染性SV40粒子と比べて約20倍程度低いが、満足のいく感染効率にまで高めることができた。当初のnaked dsDNAにより形成されるVLPから比較すると、数1,000倍以上にまで高めることができ、まさに野生SV40の再構成系が確立できたと云える。この技術開発により、球状ナノカプセル中に約5,000塩基対のdsDNAをミニクロマチンとして内包し、感染により宿主細胞核内に導入し、高効率で外来遺伝子を発現させることができた(Enomoto et al., Virology, 2011)。これも世界に先駆けての技術開発である。
以上、naked dsDNAおよびミニクロマチンによるVP1五量体の球状ナノカプセル形成誘導をまとめると、(1)dsDNAはVP1五量体の自己組織化およびナノカプセル形成を誘導する、(2)この誘導はdsDNAの形状や塩基配列に依存しない、(3)粒径45nmのナノカプセルを形成するには750塩基対以上のサイズのdsDNAが必要である、(4)dsDNAの形状とは無関係に、VP1五量体から成る45nmのナノカプセルの中には約2,000塩基対のnaked dsDNAが内包される、(5)dsDNAとヒストンあるいは高アセチル化ヒストンから成るミニクロマチンもVP15量体によるナノカプセル形成を誘導し、その中に約5,000塩基対のdsDNAが内包される。(5)ミニクロマチンと共にVP2とVP3を包含したナノカプセルを形成することも可能である。
ここで、SV40粒子形成に関して、未だいくつかの重要な課題が残されているので、ここに紹介する。(1)感染細胞の核内で、ミニクロマチンが形成され、VP1、VP2、VP3の外殻タンパク質により被覆され、SV40粒子が形成されるが、この粒子形成に細胞性因子が関与するか?、(2)関与するとすれば、細胞性因子はSV40粒子形成のどの段階に関与するか?(3)SV40ゲノム中の特異塩基配列が粒子形成に関与するか?(4)それによって、粒子形成効率やゲノムを含むミニクロマチンの粒子中への内包効率が亢進されるか?(5)VP1の特異領域がミニクロマチンの内包と粒子形成に関与するか?(6)VP1のN末端側には、塩基配列非依存的にdsDNAと結合する塩基性ドメインが存在するが、このドメインは他のポリオ−マウイルス科のウイルスにも存在し、このドメインがウイルス増殖に不可欠であることが過去の多くの論文で報告されている。VP15量体は、この塩基性ドメインを介してdsDNAと相互作用し、それがSV40粒子の形成に重要であると推測される。しかし、未だ確証は得られてない。
4-5-4. クエン酸コートフェライト粒子および人工高分子粒子
近年、我々はフェライトの一つであるマグネタイトを合成し、その表面をクエン酸でコートする技術を開発した。というのは、我々はマグネタイトにカルボキシル基がキレート結合により強く結合することを見出し、カルボキシル基を3つ持つクエン酸でマグネタイト表面をコーティングし、マグネタイトを負に荷電し、高分散性のマグネタイトを得ることに成功していた。これまでの独自の研究により、負に荷電したdsDNAがVP1五量体の塩基性ドメインと相互作用することがナノカプセル形成の引き金となると考えられたので、負に荷電したマグネタイトはナノカプセル形成誘導能があるのではないかと推理した。
そこで、クエン酸でコートしたマグネタイト粒子により、VP1五量体のナノカプセル形成が誘導されるかを検討した。粒径8nm、20nm、27nmの異なるサイズのマグネタイト粒子とVP1五量体とを混合して透析すると、各サイズのマグネタイト表面をきれいにVP1五量体で単一層に被覆できることがわかり、マグネタイトの生体分子による被覆技術が開発できた(Enomoto et al, J. Biotechnol., 2013)。
また近年、ポリスチレン、ポリシリカ、PLGAなどから成る粒径が100nm〜500nmの人工高分子粒子を単一層のVP1五量体できれいに被覆する技術が開発できた(論文準備中)。これらは主に薬剤や生理活性因子などを包含し、新規DDS用カプセルへの医療展開を目指して応用研究開発を行っている。
4-6. ナノカプセル表面の修飾・改変による細胞指向性の変換
一方、我々はナノカプセル表面を修飾・改変することでその細胞指向性を制御する技術を開発してきた。それが開発されると、ナノカプセルの感染を介して、高効率に内包した生理活性物質を生体内の標的細胞に運び込むことが可能になるからです。そこで、ナノカプセル表面に露出しているVP1のDEループ領域とHIループ領域を遺伝子工学的に改変し、細胞指向性を持つペプチド配列を挿入できる部位を挿入したり、化学的にペプチドやタンパク質を架橋できる官能基であるチオール基を持つシステイン残基を挿入することに成功している(Takahashi et al., J. Biotechnol., 2008)。
まず、細胞接着因子インテグリンと特異的に結合するRGD配列を3つタンデムに持つペプチド配列を上記のループ領域に挿入したナノカプセルは、SV40本来の膜受容体であるガングリオシドGM1と結合できなくなり、細胞指向性が変化してインテグリンと選択的に結合できることがわかった。感染前に、この改変ナノカプセルを抗インテグリン抗体と反応させると、インテグリンを持つ標的細胞との結合が阻害されることから、ナノカプセルは確かに挿入されたRGDを介して標的細胞と結合することが証明された。また、蛍光物質や発光物質を内包したナノカプセルの表面を改変することで、細胞指向性を変化できることが確かめられている(Kitai et al., J. Biotechnol., 2011)。この結果から、表面修飾・改変によりナノカプセルの細胞指向性を自在に変換できることがわかった。
次に、VP1五量体被覆マグネタイトのMRI造影剤としての有効性を検討した。まず、上記のクエン酸でコートした粒径20nmのマグネタイトをVP1五量体で被覆したものを調製した。次に、上皮成長因子(EGF)をVP1表面ループに挿入したシステイン残基のチオール基と架橋剤により化学結合した。EGFをVP1五量体被覆マグネタイト表面に固定化することによって、マウス静注後のVP1五量体被覆マグネタイトの血中の分散性や滞留性が改善されることがわかった。さらに、担がんマウスに静注すると、EGF受容体(EGFR)高発現がん細胞に選択的に集積することがMRI造影により確認された(Enomoto et al, J. Biotechnol., 2013)。ちなみに、EGFR低発現がん細胞への集積は殆ど検出されないことから、特定がん細胞への選択的な細胞指向性がVP1五量体被覆マグネタイトに付与できることがわかった。これは放医研の青木伊知男チームリーダーとの共同研究によるもので、これによりVP1被覆マグネタイトのMRI造影剤としての可能性が示された。
また近年、ポリスチレン、ポリシリカ、PLGAなどから成る粒径が100nm〜500nmの人工高分子粒子をVP1五量体で単一層にきれいに被覆する技術開発に成功した(論文準備中)。これらは主に薬剤や生理活性因子などを包含した新規DDS用カプセルとしての医療展開を目指して研究が進んでいる。
4-7. ワクチン製剤としての応用展開
これまでは、ナノカプセルをDDS用キャリアとして実用化することを主眼に置いていた。しかし、ウイルス外殻タンパク質は、一般的に、その抗原性・免疫原性のために拒絶反応を引き起こすので繰り返し行う反復投与が禁忌であり、また、アレルゲンとして重篤なアナフラキシーショックを引き起こすことがある。その解決策として、抗原性を欠如したVP1変異体を作製することであるが、VP1が持つヒトに対する複数の抗原決定基部位を特定することと、それら抗原決定基をすべて取り除くことは不可能に近い。そこで、抗原決定基部位の特定や除去に時間と労力を掛けるよりも、免疫原性を逆手に取り、その欠点を上手く活用する手立てがないかを模索した。初心に戻って素朴に考えてみると、大変魅力的な考えが閃いた。それは、ナノカプセルの免疫原性を利用して、免疫応答を増強するアジュバント(免疫補助剤)としての使い道である。そこで、抗原決定基(エピト−プ)を持つ外来ペプチドをVP1の上記の表面ル−プに挿入した組換えナノカプセルを作製した。アジュバントを添加することなく、組換えナノカプセルを単独でマウスに投与すると、抗原決定基に対する選択的な抗体産生(液性免疫)および細胞傷害性Tリンパ球(CTL)産生(細胞性免疫)を強く亢進することが確認された。特に、CTLの活性化は予想をはるかに超える強いもので、また、ナノカプセルではなく、その解離した組換えVP1ではCTL活性化は誘導されないので、アジュバント効果を発揮するにはナノカプセルという構造体が不可欠であることが示唆された。
現在、使用されているワクチン製剤には必ず何らかのアジュバント製剤が添加されており、このアジュバントの副作用によるアジュバント病の発症や線維肉腫の形成などが大きな社会的問題となっている。この副作用を解決するためにも、組換えナノカプセルが従来のアジュバント製剤と同等かあるいはそれ以上の活性を持てば、ワクチン製剤として組換えナノカプセルを開発することに大きな意義がある。そこで、我々はインフルエンザやがん細胞の抗原決定基を表面ループ内に挿入した組換えナノカプセルを作製し、組換えナノカプセルを単独でマウスに投与し、アジュバント効果としてCTLの活性化誘導を検討した。その結果、組換えナノカプセルが非常に強いCTL活性化誘導能を持つことが確認され、市販の各種アジュバント製剤とエピトープペプチドの混合液よりもはるかに強いCTL活性化が誘導された(Kawano et al., Virology, 2014)。これは組換えナノカプセルがワクチン製剤として使える可能性を示すもので、現在、組換えナノカプセルのワクチン製剤としての製品化を視野に入れた応用研究を行うと共に、さらに関連の新規技術開発を推進している。加えて、組換えナノカプセルのアジュバント効果の科学的根拠を明確にするための基礎研究を行っている。
約20年間のSV40外殻タンパク質VP1の自己組織化に関する基礎研究を通じて、VP1は単なるウイルスコンポーネントとしてだけでなく、医療分野における汎用性の多機能性タンパク質材料として極めて有用であることが証明できた。また、これまで開発してきたVP1五量体のナノカプセル形成技術や、ナノカプセル中への生理活性物質の内包技術や、ナノカプセル表面の修飾・改変による新たな細胞指向性およびアジュバント効果の付与技術は、今後の組換えナノカプセルをワクチン製剤として実用化する際に大いに役立つ基盤技術であることがわかった。今後は、これまで開発してきた様々な技術をすべて集約して、ワクチン製剤として組換えナノカプセルを製品化することを目指す。
このナノカプセルに関しては、日本DDS学会が創立20周年を記念して2005年に出版した「DDS研究の現状と将来への展望」の中に「ウイルスタンパク質ナノカプセル」という題で簡単に紹介している。また最近、2013年に出版した「メディカル・サイエンス・ダイジェスト」、2011年に出版した「Development of Vaccines: From Discovery to Clinical Testing」、2013年に出版した「Expert Rev. Vaccines」に、「ウイルスコンポーネントを用いた新規DDS担体」、「Design Platforms of Nanocapsules for Human Therapeutics or Vaccines」、「SV40 Virus-like Particles as an Effective Delivery System and Its Application to a Vaccine Carrier」というタイトルの総説を書き、ナノカプセルの医療への応用展開を紹介している。