2. 高機能性ナノ磁性ビーズ
バイオセパレーターや次世代バイオセンサなどに応用可能なナノサイズのラテックスビーズや磁性ビーズの作製とその高機能化技術に関する基礎研究から応用・実用化に向けた産学連携研究を幅広く展開している。
2-1. アフィニティクロマトグラフィ用の理想的な支持体
カラムクロマトグラフィは、静電力の違いで分離するイオン交換クロマトグラフィ、疎水的な結合力で分離する疎水クロマトグラフィ、サイズの違いで篩い分けるゲル濾過クロマトグラフィ、特異的結合力で分離するアフィニティクロマトグラフィに大別される。しかし、それら各クロマトグラフィの濃縮効率はせいぜい10倍なので、105種以上を含むタンパク質ライブラリーから目的タンパク質のみを単離・純化するには、少なくとも5つ以上の異なるクロマトグラフィによる分離工程が必要となっていた。クロマトグラフィを複数回行う過程で、サンプルのロスや失活が起こり、会合タンパク質の解離による性状変化が起こり、目的タンパク質を高純度にしかも高効率に回収することは至難の業であった。当然、タンパク質ライブラリーからじかに目的タンパク質のみを単離・純化することは出来なかった。
その不可能を実現可能にする技術としては、アフィニティクロマトグラフィしかないと考え、従来のアフィニティカラムクロマトグラフィの長所と短所を徹底的に調べ、カラム法の替わりにバッチ法を使用し、しかも従来から金科玉条の如く用いられている支持体(担体)であるアガロースをはるかに凌ぐ新規支持体の作製に取り掛かった。アフィニティクロマトグラフィの理想は、各種ライブライリーからじかに(1)高回収率、(2)高純度、(3)短時間、しかも(4)活性を保持した無傷の目的タンパク質を単離・純化できることである。それを実現可能にする支持体が持つべき性能・形状・サイズを考えた。まず、(1)高回収率に関して、ライブラリーの中に含まれる目的タンパク質のほぼすべてを高効率に回収するには、目的タンパク質と選択的に結合するリガンドを多量に支持体表面に固定化することと、結合反応液中では小さな支持体が高分散性、浮遊性、可動性、安定性で、目的タンパク質が一旦解離しても直ぐに他の固定化リガンドと再結合する状態が保てることである。次に、(2)高純度に関して、通常はタンパク質ライブラリーを使う場合、夾雑タンパク質の疎水的結合や静電的結合が起こり、支持体への非特異的結合が特異的結合をはるかに上回るために、純度は極めて低い。そこで、支持体の非特異的結合を可能な限り減らすために、支持体表面から疎水性を無くし、適度な親水性(水の接触角は50〜60度)が保てるように工夫した。また、支持体は無孔性にして夾雑物の捕捉を防止した。(3)、(4)短時間と無傷のタンパク質回収に関しては、ライブラリーから直に単一工程ですべての選択的結合タンパク質を回収できるようにした。
さらに、(5)有機溶媒に耐性なビーズの作製である。というのは、薬剤などの低分子化合物の多くは難水溶性で、有機溶媒にしか溶けない。そこで、有機溶媒中でビーズ表面に化合物が固定でき、水溶液で洗浄後に、ライブラリーから目的タンパク質を水溶液中でアフィニティ精製できるようにビーズを作製した。
2-2. ラテックスビーズ
20数年前に上記の理想的条件のすべてを満たす支持体として、ナノサイズのラテックスビ−ズが頭に浮かび、慶應義塾大学大学院理工学研究科の川口春馬博士と共同研究を始めた。何故、ラテックスビ−ズかと云うと、従来から使われているアガロース(粒径200μm)の1/1000以下なので、支持体の総表面積が従来の1000倍以上に拡大できる。その結果、単位容積当たりのリガンド固定化量が桁外れに増え、おのずとリガンドと結合するタ−ゲット量が増大し、回収効率が著しく向上すると考えた。加えて、結合反応中において微小な支持体が高分散性、可動性、浮遊性、安定性であれば、支持体に固定化されたリガンドと一旦結合したタンパク質が解離しても、すぐに近くにあるリガンドと再結合および再々結合できるので、回収効率がさらに向上すると考えた。
また、遠心分離法で収集・回収されるラテックスビ−ズの沈澱容積が極小に制御できるので、夾雑物の混入を大幅に低減でき、純度を高めることができると考えた。一番苦労した点は、ビ−ズ作製に際し、アフィニティ精製物の純度が高ければ高いほど優れた支持体と云えるので、夾雑物の非特異的結合が極端に少ない支持体を作製しようと考えた。
そこで、数多くのモノマ−を単独でポリマ−化することで数多くの異なるビ−ズを作製し、それらの非特異的結合を評価するために、各ビ−ズをタンパク質ライブラリ−である培養細胞破砕液と混合し、ビ−ズ表面に非特異的に結合するタンパク質をSDS-ポリアクリルアミドゲル電気泳動法(PAGE)で分画後、銀染色により可視化した。その結果、グリシジルメタクリレ−ト(GMA)から成るポリGMAビ−ズが、静電的結合や疎水的結合による夾雑物の非特異的結合が驚異的に少ないことを見出した。
このGMAとの出会いが、まさに我々のビ−ズ開発の出発点となった。GMAの発掘は浅井章良博士(現静岡県立大学)の貢献である。ちなみに、ポリGMAビ−ズは、その表面と水滴との接触角が50~60度を示し、適度な親水性表面と云える。
このポリGMAビ−ズに2本鎖(ds)DNAを固定化すると、特異塩基配列を認識するDNA結合性転写因子が細胞抽出液から直に分離・濃縮できた(Kawaguchi
et al., Nucleic Acids Res., 1989)。ところが、このビ−ズでは洗浄や回収時に繰り返し行う遠心分離操作で徐々に壊れるという欠点が見つかった.
そこで、より強固なビ−ズを作製することを考え、スチレン(Styrene)とGMAから成る共重合体ビ−ズを作製してみた。このビ−ズは確かに強固にはなったが、スチレンのベンゼン環の疎水性のために非特異的結合が起こり、純度が大きく低下することがわかった。
その解決策として頭に浮かんだ名案は、スチレン-GMA共重合体をさらにGMAのみでシ−ド重合を行うことで表面をポリGMAで完全に被覆することであった。それを実践した結果、非特異的結合は極めて少なく、理想的支持体の諸条件をほぼすべて満足するラテックスビ−ズが作製できた。これをSG(Styrene・GMA)ビ−ズと名付け(Inomata et al., Anal. Biochem., 1992)、各種リガンドを化学結合により表面に固定化し、ビ−ズを高機能化する技術開発を本格的に始めた。SGビ−ズ表面はポリGMAで構成されており、リガンドやリンカ−(スペーサー)の固定化に使えるエポキシ基がビーズ1個当たり1x107個以上存在している。このSGビ−ズ作製の成功と高機能化技術の確立は、ひとえに猪股幸雄博士(現花王株式会社)の貢献によるものであり、猪股氏の優れた頭脳と最後までやり抜く実行力に心から敬意を表する。
SGビーズを使って最初に行ったのは、dsDNAをビーズ表面に固定化して高機能化を図った。調製した約250塩基対長のdsDNAは、二つの機能部位を持っている。その一つは特異塩基配列がいくつかタンデムに並んだ2本鎖DNAで、これはDNA結合性転写因子が特異的に認識・結合する部分である。他の一つは、グアニン(G)塩基が数個並んだ1本鎖末端部分で、これはエポキシ基との反応性が最も強いG塩基を介してdsDNAをビ−ズに固定化するためである。その固定化反応は極めて簡単で、SGビ−ズと過剰量のdsDNAを純水中で混合し、30℃以上に反応温度を温めると、ビ−ズ表面のエポキシ基とDNA末端のG塩基との間で化学結合が容易に起こる(Wada et al., Methods Enzymol., 1995)。
次に、作製したdsDNA固定化SGビ−ズと細胞核破砕液とをよく混合し、洗浄後に、DNA結合性転写因子であるCREB/ATFを溶出すると、同じ特定塩基配列を認識するCREB/ATFファミリ−に属する8つのメンバ−が全て単一工程で回収でき、同時に、それらメンバ−と会合する酵素や因子が共分離される(Wada et al., J.Virol., 1991)。これは、従来法では不可能であったことを実現可能にした革新的な技術開発である。また、二つ以上のサブユニットから成る転写因子複合体(Watanabe et al., Mol. Cell. Biol., 1993)およ
びリン酸化(Kang et al., Genes Dev., 2009)や糖負荷(Kang et al., FASEB J., 2013)など翻訳後修飾の解析にも驚異的な威力を発揮することがわかった。さらに、このビ−ズ技術から端を発し、我々は転写伸長段階におけるmRNA合成速度をブレ−キやアクセルで制御する新規な制御因子DSIF(Wada et al., Genes Dev., 1998)およびNELF(Yamaguchi et al., Cell, 1999)を発見し、それら因子による転写伸長制御の発生・分化や細胞がん化などにおける生物学的重要性を解き明かした(Guo et al., Nature, 2001; Yamaguchi et al., Science, 2001)。この業績は国際的にも高く評価され、分子生物学や生化学の教科書に掲載されている。
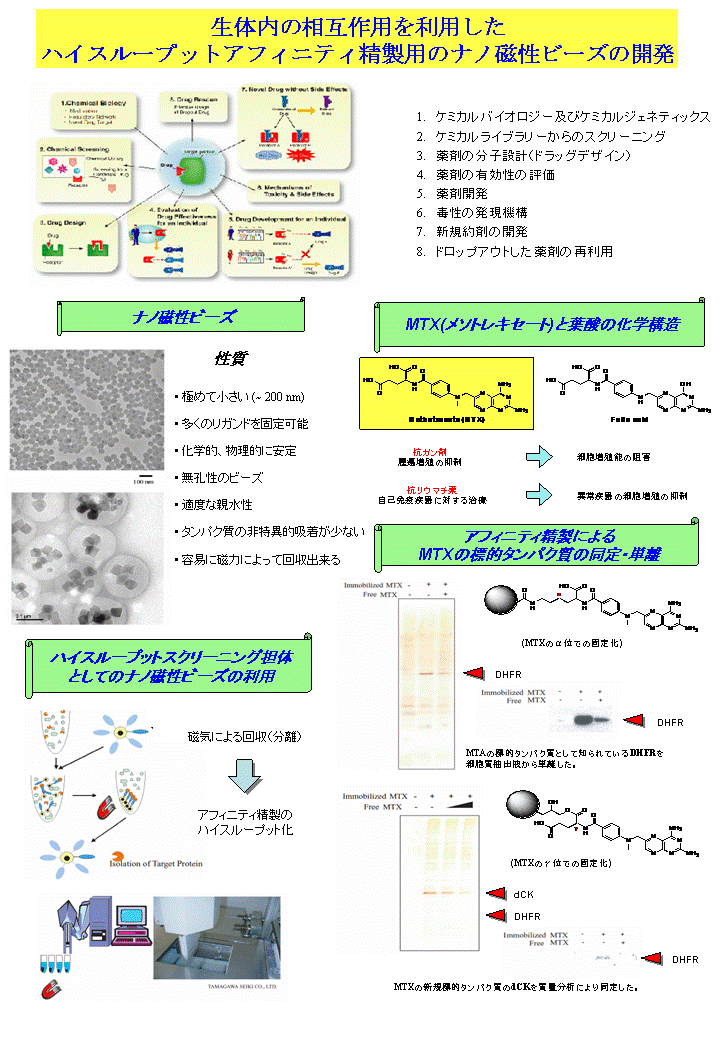
また、薬剤など低分子化合物をビ−ズ表面に直接固定化すると、高分子であるタンパク質が立体障害のために結合できない。そこで、リンカ−(スペーサー)を介して固定化することを考え、多数のリンカ−候補物質を検討した。その結果、EGDE(Ethylene Glycol Diglycidyl Ether)が非特異的吸着が最も少なく、かつ巨大なタンパク質複合体も結合できることがわかった。そこで、EGDEリンカ−を介して低分子の薬剤をビ−ズに固定化し、,薬剤と結合するタンパク質を細胞抽出液から単一工程で分離・同定するシステムが一応完成した(Shimizu et al., Nature Biotech., 2000)。しかし、SGビ−ズによる分離操作では、全ての過程で手作業を要し、多くのサンプルを一度に処理することはできない。そこで、磁石で捕集・回収可能な磁性ビ−ズの開発に取り組んだ。
SGビーズ表面に様々な分子をリガンドとして固定化した機能性SGビーズは、アフィニティ精製に革新的な機能を発揮するので、大学シーズを企業と産学連携で応用展開するという経済産業省・大学主導型産学官連携プロジェクトに採択された。そして「微粒子利用型生体結合物質等創製技術の研究開発」というテーマで、平成10年度〜14年度の5年間に、薬剤のターゲット(標的タンパク質)を単離・同定し、薬剤の作用メカニズムを解明し、得られた知見・情報を創薬に役立てる目的に応用展開された。ここで、ターゲットとは薬剤と特異的に結合し、薬理作用に直接関わる生体内のタンパク質のことを云う。また、タンパク質のアフィニティクロマトグラフィにおいて、支持体としてラテックスビーズを用いるのは、世界ではじめてのことでした。このプロジェクトに参加した企業は、旭化成(株)、協和発酵(株)、東レ(株)、山之内製薬(株)、藤沢薬品工業(株)第一製薬(株)の6社で、薬剤など低分子化合物のターゲットの探索系を開発し、主作用や副作用のメカニズムを理解し、創薬に役立てる基盤技術開発が目的です。この成果により、ナノサイズのラテックスビーズが極めて有効なアフィニティ精製用支持体であることを示し、その革新的なビーズの機能・性能を立証することができた。即ち、開発したSGビーズ表面に多彩なリガンドを目的に応じて固定化したものは、タンパク質ライブラリーや化合物ライブラリーからリガンドとして固定化された薬剤やタンパク質と選択的に結合するターゲットであるタンパク質あるいは化合物をそれぞれ単一工程で、しかも高純度かつ高回収効率でアフィニティ精製できることがわかった。これは従来法では出来なかったことが実現可能になった革新的技術開発だということを示すものです。この開発技術に関連する知的財産は、我が国ではじめて設立された東京工業大学TLOを介して、いくつかの大手製薬企業へライセンシングされ、有用性が評価されている。
2-3. 磁性ビーズ
ところが時代の流れに即して、ハイスループット装置の開発が望まれるようになった。というのは、ラテクスビーズではすべての操作を手作業で行わねばならず、多サンプルの同時解析が困難で、操作の自動化が求められるようになった。それで、自動化が可能な磁性ビーズを作製する基本技術開発を、経済産業省フォーカス21「ナノ微粒子利用スクリーニングプロジェクト」(平成14〜17年)で行った。これに参加した企業は、第一製薬(株)、山之内製薬(株)、キャノン(株)、多摩川精機(株)、(株)アフェニックス、みずほ情報総研(株)の6社で、3年間という短期間にも関わらず、以下に述べる革新的なナノ磁性ビーズの開発に成功した。
2-3-1. ナノ磁性(FG)ビーズ
SGビ−ズが非常に優れているので、その長所をフルに生かすために、磁性酸化鉄であるマグネタイトをSGビ−ズ内に封入することを考えた。丁度、東工大百年記念館の地下展示場で、マグネタイトを含むフェライトが東工大の加藤与五郎博士と武井武博士により発明され、その研究が伝統的に継承されていることを知った。そこで、学内の数名の専門家を訪ねて相談に行き、運よく阿部正紀博士と出会うことができた。通常、マグネタイトは高温や高pH条件下で合成されるが、阿部博士は低温・中性条件下で合成する技術を確立していた。このマイルドな合成法に大変興味を持った。というのは、タンパク質などの生体分子は高温や高pHでは変性・失活するが、低温・中性条件下では活性が保持されると考え、マイルドな条件下で酵素活性を持つタンパク質存在下でマグネタイトの合成を試みた。すると面白いことに、磁性のマグネタイトが合成され、しかも、磁石による捕集画分に酵素活性が検出されることから、酵素が活性を保持したままマグネタイトと結合することがわかった。
そこで、酵素であるタンパク質の構成成分である20種類のアミノ酸に目をつけ、各アミノ酸とマグネタイトとの結合を解析した。その結果、アスパラギン酸(Asp)、グルタミン酸(Glu)、システイン(Cys)が最も強くマグネタイトと結合することがわかった。ところが、Cysはスピンネル構造を乱し、マグネタイトの飽和磁化を下げるので、AspとGluに的を絞り、それらの共通構造である二つのカルボキシル基にヒントを得て、アミノ酸以外のリンゴ酸とオキサル酢酸を試みた。すると、マグネタイトと強く結合し、その結合様式を解析すると、両者共にカルボキシル基を介してキレ−ト結合していることがわかった。さらに、Aspをマグネタイト合成反応中に添加するのではなく、一旦合成したマグネタイトに後添加しても、カルボキシル基を介して強く結合することがわかった。
その時に頭に浮かんだのが、マグネタイトとの結合に使えるカルボキシル基と重合反応に使えるビニ−ル基を併せ持つ化合物である。この化合物がマグネタイトと結合すれば、ビニール基を開始点とする成長反応が起こりマグネタイトをポリマーで被覆できるのではと考えた。このような化合物を「アダプタ−分子」と名付け、いくつかのアダプタ−候補分子や反応条件を綿密に検討し、最終的に、アダプタ−分子として10-ウンデセン酸を選び、
ポリマ−化反応にAdmicellar重合法を選択することで、マグネタイトをポリマ−で完璧に被覆する技術が完成した。
また、マグネタイトの合成反応の温度を調節することで、サイズや均一性を制御するシステムを独自に確立し、数nmから35nmの間であれば、いかなるサイズでもほぼ均一のマグネタイトが合成できるようになった。また、いずれのサイズもマグネタイトもポリマ−で首尾よく被覆できるが、サイズが小さいと飽和磁化が低く、磁石で捕集できない。それで、最終的に35nmのマグネタイトに絞って、アダプタ−分子を介した様々なポリマ−化反応を試みた。結果として、SGビ−ズの場合と同様に、初めにスチレンとGMAから成る共重合体で被覆し、その後にGMAのみのシ−ド重合による2段階被覆に落ち着いた。これによって磁石で捕集可能な粒径約200nmのFG(Ferrite-GMA)ビ−ズと呼ばれる磁性ビ−ズが完成し(Nishio et al., Colloid and Surfaces B: Biointerfaces, 2007)、その後に、少し小さな粒径140nmの改良型FGビ−ズが完成した(Sakamoto et al., Chem. Rec., 2009)。FGビ−ズは約35nmのマグネタイトを数個内包し、SGビ−ズと全く同じ表面性状を有する。しかし、SGビ−ズと比べると、有機溶媒に対して格段に強い耐性を示す。従って、FGビ−ズは多様な有機溶媒中でリガンドが固定化でき、水溶液中でリガンド結合タンパク質が分離できる。このように、FGビ−ズは有機溶媒と水溶液を自在に往復できる汎用性を有する。この優れた性能は市販の支持体には備わってない。また、磁石による捕集も可能で、濃縮効率も数100倍以上で、まさに理想的な支持体である。このFGビ−ズの完成は、ひとえに西尾広介博士(現テルモ株式会社)の多大な貢献によるもので、彼の優れた頭脳と最後までやり抜く行動力に心から敬意を表する。
ここで、SG/FGビ−ズがアフィニティ精製用の支持体としての優れた特徴を挙げると、(1)非特異的なバックグラウンドノイズが極低で、精製物は高純度である、(2)リガンド固定化量が多く、分散性・可動性・浮遊性の微小支持体なので、回収率が極めて高い、(3)有機溶媒と水溶液との間の往復が可能で、各種リガンドに応じて表面官能基の改変が容易である。
これら優れたSG/FGビ−ズの特徴は、リガンドと結合する全ての因子(タンパク質でも化合物でも)を各種ライブラリ−からじかに高純度かつ高回収効率に、しかも、スモ−ルスケ−ル(遠心チュ−ブ)かつ単一工程(短時間)で分離・濃縮することを実現可能にした。その際、結合定数が103Mであっても、リガンドと選択的に結合する因子の分離・濃縮が可能である。
分離操作は単一工程ででしかも簡便なので、リガンドと結合因子との間の相互作用に関する情報、(1)結合様式(疎水的や静電的など)、(2)結合親和力、(3)結合特異性、(4)濃縮効率などが短時間内に入手でき、得られた情報をもとに、複数の薬剤結合タンパク質の中から薬理作用に関わるタ−ゲットが推定できる。
薬剤のタ−ゲットが同定できると、化合物の作用メカニズムが解明でき、生命科学の基礎研究にも貢献し、同時に、タ−ゲット関連の制御ネットワ−クが理解でき、疾患診断マ−カ−の発掘や新規治療薬の開発への応用展開が可能となる。従って、我々の開発したビ−ズ技術はケミカルバイオロジ−分野に広く貢献しており、合成薬剤、天然化合物、病原性因子、毒性化合物など多くの化合物のタ−ゲット探索に有用性を発揮している。
我々がサリドマイド催奇性の原因因子として発見したCRBN(cereblon)は(Ito et al., Science, 2010)、最近、主作用である抗がん作用にも関与することがわかり(Lopez-Girona et al., Leukemia, 2012)、新規薬剤開発に向けて米国の製薬企業との共同研究に発展し、まさに、ビ−ズ技術の新たな展開期を迎えている.
機能性ナノ磁性ビーズは、アフィニティ精製用支持体として革新的な性能を発揮し、磁石によって容易に回収できるので、これを用いたスクリーニング用ロボットも開発できました。経済産業省やNEDOの支援による産学連携研究開発により、各種のSG/FGビーズと共に、創薬に役立つアフィニティ精製用自動化装置として多摩川精機(株)との共同開発に成功し、現在は製品化され、市販されています。SG/FGビーズは「半田ビーズ」としても知られるようになり、年々国内での売り上げは増加している。
2-3-2. ナノ磁性ビーズの有効利用法
ナノ磁性ビーズの特性は、これまで述べてきた「磁石による回収」ばかりでなく、外部磁場により目的部位への輸送・集積および交流磁場による発熱などの「外部磁場への応答」や、磁性ビーズが持つ磁気をセンシングする「磁気の検出」にも利用できることである。従って、ナノ磁性ビーズは、アフィニティ精製用支持体として有用であるばかりでなく、DDS用キャリア、温熱発熱体、バイオセンシング用プローブとしての有用性が期待される。
我々は、当時東京工業大学のアダルシュ・サンデュ准教授(現豊橋技術大学教授)、阿部正紀教授と共同して、ホール素子と機能性ナノ磁性ビーズとの組み合わせによるバイオセンサーの開発に挑戦し、平成18年から3年間、科学技術振興調整費で「独創的ホール検出システムと磁性ナノビーズを用いた超高感度バイオセンサーの開発」プロジェクトを立ち上げ、磁気センサーのプロトタイプの作製に成功した。ところが、このホールセンサー装置の検出感度が期待したほど高くなく、それを克服する技術開発にいろんな問題があって解決困難と判断し、現在、別の切り口から機能性ナノ磁性ビーズを用いたバイオセンシング装置の開発に取り組んでいる。
また、2005年に東京工業大学は、文部科学省科学技術振興調整費「戦略的研究拠点育成プロジェクト(スーパーCOE)」を獲得し、統合研究院を設立した。2007年から統合研究院の専任教授(大学院生命理工学研究科教授を兼任)となり、ソリューション研究機構プロジェクトである「医療・バイオプロジェクト」のリーダーとして、学内の電気電子工学、電子物理工学、高分子化学、バイオテクノロジー、有機合成化学など極めて多岐にわたる専門分野から成る共同研究グループを組織し、それに加えて、学外研究機関である慶応義塾大学医学部、東京大学医科学研究所、秋田大学医学部、東邦大学医学部、東京医科歯科大学、国立がんセンター、放射線医学総合研究所と共同研究を行い、企業も参画し、ナノ磁性ビーズの医療への実用化に向けて応用研究を展開してきた。
現在、JSTの先端計測分析技術・機械開発プロジェクト「微粒子検出によるエキソゾーム高精度定量技術の開発」をJVCケンウッドと慶応技術大学医学部との共同研究開発を2012年より開始した。これはDVD上でナノ磁性ビーズを用いて定量する技術開発で、基盤研究がほぼ終了し、出口の実用化・製品化に向けての本格的な装置開発の段階に入っている。
さらに、これまでのビーズとは異なるタイプの機能性ナノ磁性ビーズの開発も精力的に進めており、それと同時に、電気的検出系、光学的検出系、磁気的検出系といった次世代センサーの開発に向けた研究を産学連携で進めている。特に、粒径20nmおよび28nmのマグネタイトをヒトに無害なウイルスであるsimian virus 40(SV40)粒子の外殻タンパク質VP1五量体で単一層に被覆し、さらに表面のVP1を抗体などのタンパク質や化合物で固定化することで修飾する技術開発にも成功している。このVP1被覆マグネタイトは極めて高い分散性を有し、表面に上皮成長因子(EGF)を化学結合したものをEGFR高発現がん細胞を移植された担がんマウスに静注すると、EGFR高発現がん細胞に選択的に集積することがMRI造影により確認された(Enomoto et al., J. Biotechnol., 2013)。ちなみに、対照としてEGFR低発現がん細胞には集積しないことから、このVP1被覆マグネタイトはMRI造影剤としての応用が期待できる。それに加えて、ハイパーサーミア剤やバイオセンサー用プローブとしての応用展開も期待される。
アフィニティ精製用担体としてのSGビーズやFGビーズに関しては、川口春馬名誉教授との共著で「ナノアフィニティビーズのすべて」(中山書店)を2003年に出版しているが、2004年にCMC出版のバイオ専門情報誌「バイオインダストリー」に、阿部正紀博士らと共に「バイオ・医療を志向する次世代の磁性微粒子」という特集号を出版している。その特集号が極めて好評であったので、内容をより充実させ、2006年に磁性ビーズのバイオ・環境技術への応用展開」(半田宏、阿部正紀、野田紘憙監修)を同社から出版している。また、関連の共著書としては、「ナノ粒子分散系の化学と技術」(角田光雄監修)シーエムシー出版(2006)、「ソフトナノテクノロジー −バイオマテリアル革命−」(田中順三、下村政嗣監修)シーエムシー出版(2005)、「ナノ粒子・マイクロ粒子の最先端技術」(川口春馬監修)シーエムシー出版(2004)などもある。
2-4. 蛍光・磁性(FF)ビーズ
FGビ−ズに、さらに蛍光機能を付加すると、高速・高感度疾患診断が実現できると考えた。というのは、抗体を固定化した蛍光・磁性ビ−ズを磁石によって抗原の存在する特定部位に捕集できれば、抗原・抗体反応に要する時間が短縮でき、しかも、蛍光強度が充分あれば、従来の検出時の酵素反応やPCR反応などの増幅反応も不要となり、さらなる時間短縮が期待できる。これまで数時間から数日掛かる全行程を、わずか数分以内に完結するという企画である。そこでまず、ビ−ズ内に封入する蛍光物質を検討した。その結果、ユ−ロピウム錯体を選んだ。その理由は、(1)水となじみ難い疎水性なので、有機溶媒中でビ−ズ内へ容易に封入される。また、(2)励起波長が340nmで蛍光波長が618nmという大きなスト−クスシフトを持つので、ビ−ズ内に過剰量を封入しても濃度消光が起こり難い。さらに、(3)ユ−ロピウム錯体の蛍光半減期は長く、時間分解蛍光測定が可能で、他の蛍光物質と比べてはるかに高いS/N比が得られる。
開発したFGビ−ズは粒径が140nmと200nmの2種類があり、ユ−ロピウム錯体を実際に封入すると、それぞれに約5x105個と約1x106個が封入され、いずれも蛍光顕微鏡下でビ−ズ1個が検出でき、この蛍光・磁性ビ−ズをFF(Fluorescent-Ferrite)ビ−ズと呼ぶことにした(Sakamoto et al., Clin. Chem., 2014)。
これまでは微量な抗原検出でシグナルを増強するために、抗原・抗体反応後に酵素反応やPCR反応など時間が掛かる増幅反応を行っているが、FFビ−ズでは迅速な抗原・抗体反応の後に直ぐに検出できるという優れた特長を持つ。このFFビーズの作製は主に北善紀氏(現藤倉化成株式会社)と望月勇輔博士(現富士フィルム株式会社)の貢献によるもので、彼らにここに謝意を表したい。
FFビ−ズの特徴として、(1)永久磁石により容易に磁気捕集ができる、(2)粒子中にユ−ロピウム錯体が多量封入され、1粒子で検出可能である、(3)封入されたユ−ロピウム錯体は水中で漏洩することはない、(4)時間分解蛍光測定ができ、S/N比が高い、(5)通常のELISAによる96ウェル測定でも、1ウェル中にFFビ−ズが100個も有れば検出できる、(6)市販のFGビ−ズと全く同じ表面性状で、同様のサイズと形状を持ち、水中で高分散性・可動性である、(7)EDTA処理やpH変化で消光しないことから、ユ−ロピウム錯体はビ−ズの内に完全に封入されている、(8)SG/FGビ−ズと同様にビ−ズ表面への夾雑物の非特異的結合が極少である、などが挙げられる。
疾患マ−カ−の診断は、通常2つの抗原認識部位の異なる抗体による酵素免疫測定法(ELISA)によるサンドイッチ法が行われる。片方の抗体(固相化抗体)は検出用基板上に固定化され、他方の抗体(検出抗体)は酵素や蛍光で標識される。まず、固層化抗体で疾患マ−カ−である抗原をトラップし、検出抗体でサンドイッチし、洗浄後に検出する。時には、さらに検出抗体と反応する酵素標識した標識抗体を用いてシグナルの増幅を図る。いずれにしても、その際の課題は、2つ以上の抗原・抗体反応とシグナルの増幅反応に長時間を要することである。この時間的課題の解決に、FFビ−ズは極めて有効である。
抗原・抗体反応をスム−ズに進行させるために、ビ−ズ表面や検出用基板の上に抗原や抗体をEGDEリンカ−を介して固定化する。これにより固定化タンパク質の配向が少しは改善されるからである。但し、長鎖DNAはその片末端で固定化するのでリンカ−は不要である。また、抗原や抗体をリンカ−末端に固定化する場合には、通常はクロスリンカ−と呼ばれる架橋剤を用いる。我々は、架橋剤による固定化法とは別に、イミダゾ−ル基とエポキシ基との間で化学結合が良く起こることを見出したので、架橋剤を用いずに、組換えタンパク質をHisタグのイミダゾ−ル基を介して選択的にFFビ−ズのリンカ−末端のエポキシ基に固定化できるようになった。
これまで核酸や抗体を固定化したFFビ−ズと検出用基板との間で、核酸ハイブリッド形成により1分以内という迅速な核酸診断や、抗体によるサンドイッチ法により心疾患や前立腺がんのマ−カ−であるpMオ−ダ−のBNPやμMオ−ダ−のPSAが5分以内で高速診断できることを示した(Sakamoto et al., Clin. Chem., 2014)。今後、材料や計測法の改良・改善を進め、さらなる時間短縮や高感度・高精度化を目指す。また、抗体固定化FFビ−ズは迅速病理診断にも応用できるので、今後、FFビ−ズの機能化技術や自動化診断装置の開発を行い、診察中や手術中での高速・高感度・高精度疾患診断用のプロ−ブとしての製品化や診断装置の開発を図る.
2009年からNEDOナノテク先端部材実用化研究開発プロジェクト「高機能性蛍光磁性ビーズによる高速・高感度疾患診断システムの開発」を、凸版印刷(株)、多摩川精機(株)、慶應義塾大学医学部と共同ではじめ、液体クロマト検出装置のプロトタイプはほぼ出来上がり、現在、臨床現場における有用性を検討している。その結果を踏まえ、実用化に向けた本格的な製品開発を行うことになっている。
2-5. 「サイエンスは個性&プライド」
サイエンスとは己の考えを一般化・普遍化するもので、プライドが無ければできないことである。そこで、「サイエンスは個性&プライド」を研究モットーとして、独り善がりの研究をこれまでやり続けてきた。また、「サイエンスを極めるには独自の技術開発が役に立つ」ことを留学先のMITで学び、全く異分野である高分子化学やフェライト工学を要する機能性ラテックスおよび磁性ビーズの作製に挑戦し、いろんな困難はあったが、失敗を楽しみながら「半田ビ−ズ」を完成し、実用化・製品化まで何とかやり遂げたことは、医学部で育ち、医師免許を持つ私にとっては感慨無量である。
さらに、独自に開発したビ−ズ技術から大きく展開した業績が二つある。その一つはmRNA合成速度をブレ−キやアクセルで制御する2つの新規因子DSIFとNELFの発見である。この研究成果は、教科書にも取り上げられ、最近、その制御が発生・分化や細胞がん化など生物学的に極めて重要であることが年々明らかにされており、独自の転写伸長反応に関する研究が世界における生命科学に貢献できたことである。その二つ目は、米国製薬企業のCelgene社との共同研究にまで発展した成果で、ビ−ズ技術によって、サリドマイドのターゲットで、催奇性の原因因子であるCRBNを発見したことである。また近年、CRBNがサリドマイドの催奇性という副作用だけでなく、抗がん作用や免疫調節作用という主作用にも関与することを明らかにし、E3ユビキチンリガーゼの基質受容体であるCRBNの基質がIkarosとAilosという転写因子を解明したことで、サリドマイドおよびその誘導体の抗がん作用や免疫調節作用のメカニズムの一端を明らかにすることができた。これはサイエンスに多大な貢献ができ、全く異分野であった創薬開発にまで発展した我が国の素晴らしい業績と思われる。
このように、開発したビ−ズの製品化に加え、基礎研究と応用研究のいずれにおいても社会的貢献ができたことは無上の喜びである。これまでの私の全ての業績に関して、東京工業大学生命理工学研究科の半田塾の優秀な学生諸君の全員に心から謝意を表する。また、東京工業大学において、常に激励し続けてくれた遠藤剛博士(東工大名誉教授、近畿大学副学長)と(故)清水勇博士(元東工大名誉教授、元INPIT理事長)に心から感謝する。