宮澤・平本チーム
トップページ > 研究内容> 研究概要>研究チーム>宮澤・平本チーム
当研究チームでは、多発性骨髄腫をはじめ、がんを主な対象疾患とし、オートファジー誘導/阻害方法の開発を目指して、マクロライド系抗生剤などに対する分子標的の解析を行っています。
概略
多発性骨髄腫は単クローン性γ-グロブリンの産生を特徴とする難治性腫瘍であり、多発性骨髄腫細胞ではタンパク質合成・分泌が盛んに行われています。小胞体内腔に不良タンパクが蓄積すると、ユビキチン化を受け、プロテアソームに運ばれて分解されますが、この処理能力を上回る不良タンパクの蓄積によりアポトーシスが誘導されます。
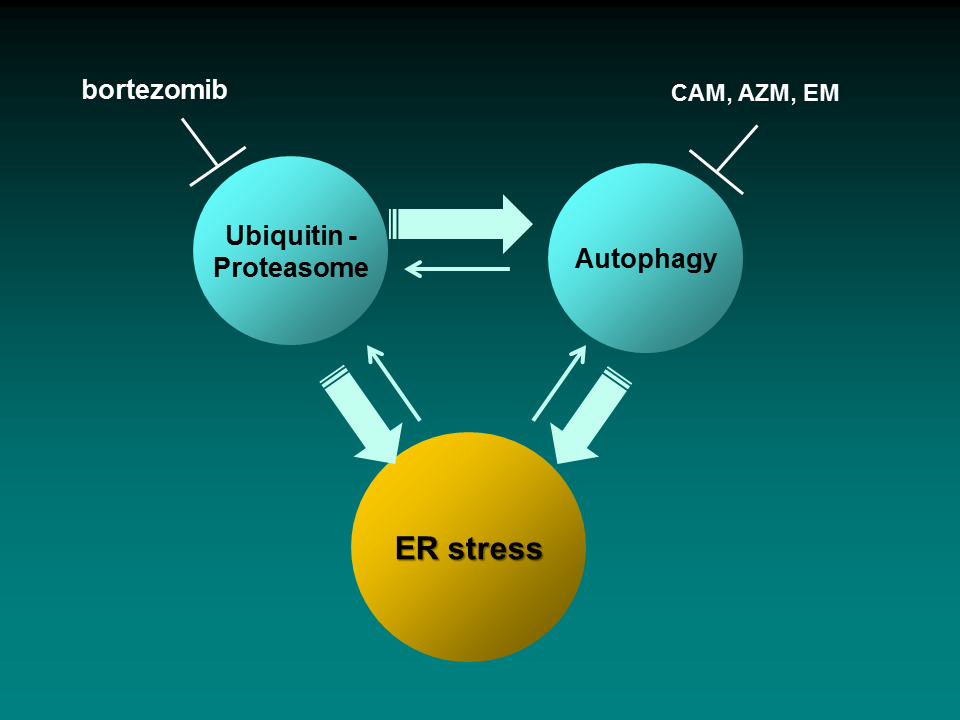
我々はこれまで、ユビキチン-プロテアソーム系およびオートファジー-リソソーム系の二大タンパク質分解系と、小胞体とを含めた三者間の細胞内ネットワークに着目して解析を行ってきました。最近の解析で、マクロライド系抗生剤によるオートファジー阻害効果を発見し、プロテアソーム阻害剤との併用で細胞内二大タンパク質分解系を同時に止めることで、小胞体ストレス負荷を介した、がん細胞死が強力に誘導されること報告しました(Komatsu
et al., 2012; Moriya et al., 2013; Komatsu et al., 2013)。
本プロジェクトでは、難治性多発性骨髄腫の新規治療を目指して、
1.我々が発見したマクロライド系抗生剤のオートファジー阻害活性における「分子標的」の同定を行い、
2.プロテアソーム阻害剤とマクロライドとの同時併用で期待される、小胞体ストレス負荷を介した強力な細胞死誘導効果について、分子レベルでのメカニズム解析と、動物実験による治療効果検証との両面から進めます。
研究内容
私たちはこれまでに以下の項目を明らかにしました。
① 多発性骨髄腫細胞にプロテアソーム阻害剤ボルテゾミブ(BZ)を作用させるとオートファジーが強力に誘導される。
② クラリスロマイシン(CAM)など多くのマクロライド系抗生剤は、オートファジーの後半プロセスを阻害する活性を有し、単剤では全く細胞毒性を示さないものの、BZと併用することで、多発性骨髄腫細胞や乳癌細胞に対して強力なアポトーシス効果を誘導する。
③ BZ+CAM併用で、細胞内のユビキチン化タンパク質の蓄積とアグリソーム形成が亢進し、これと連動して小胞体ストレスが一挙に高まる。(ただし、BZ単独の小胞体ストレス負荷は弱い。)
④ 小胞体ストレス誘導性転写因子CHOPノックアウトマウス由来線維芽細胞および、多発性骨髄腫細胞を用いたsiRNAによるCHOPノックダウン実験では、BZ+CAM併用によるアポトーシス増強がほぼ完全に抑制された。
これら一連の実験結果から、1.細胞内二大タンパク質分解系と小胞体間の巧妙な“ネットワーク”の存在が示唆されること、および、2.タンパク質合成・分泌が旺盛な多発性骨髄腫細胞において、小胞体ストレス負荷によるアポトーシス誘導が従来の認識を超えて極めて有用な“治療手段”となり得る可能性を見出しました。ただし、ツニカマイシンやタプシガルギンに代表される小胞体ストレス誘導剤は細胞毒性が強く、人体へ投与することはできません。一方、嚢胞性線維症患者へのマクロライド系抗生剤アジスロマイシン(AZM)の長期投与では、非定型抗酸菌症の発症リスクが高まることが報告されました。興味深いことには、AZMによる肺胞マクロファージのオートファジー阻害、それによるマイコバクテリウムのクリアランス低下、が発症背景にあることが明らかになりました (Renna M et al. J Clin Invest. 2011)。この“副作用”に関する報告は、視点を変えればAZMの通常投与量で、オートファジー阻害という“薬理効果”が得られることを意味しています。
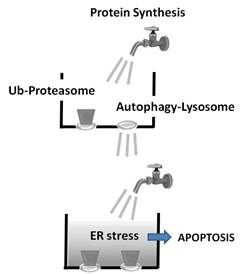
以上より、1.マクロライド系抗生剤が人体への投与が可能な「オートファジー阻害薬」となり得ること、および難治性多発性骨髄腫患者に対してプロテアソーム阻害剤と併用することで、2.細胞内の二大タンパク質分解系の同時阻害による「小胞体ストレス誘導療法(ER stress-loading therapy)」という新たな概念に基づく治療が可能であること、を発想するに至りました。つまり、オートファジーの流れ(flux)を止めるマクロライド系抗生剤と、プロテアソーム阻害剤とを併用することで、過度な小胞体ストレス負荷により殺細胞効果が得られる現象は、排水口が二つあるシンクに例えることができます。すなわち、BZで一方のプロテアソームによる分解系を止めても、二大タンパク質分解系のクロストークによりオートファジー-リソソーム系で不良タンパク質は分解・処理されます。このためシンク内の水(=小胞体ストレス)は溜まりません。しかし、さらにマクロライド系抗生剤でオートファジー系も同時に止めると、一挙にシンク内に水が溜まります。本プロジェクトは我々の最新の研究成果と、「細胞内二大タンパク分解系と小胞体間のネットワーク」および「小胞体ストレス負荷による多発性骨髄腫細胞死誘導」という二つのアイデイアに立脚したものです。
そこで本プロジェクトでは、磁性ナノビーズにマクロライド系抗生剤を固相化し、ハイスループットアフィニテイー精製と質量分析とを用いることで、マクロライド系抗生剤の「分子標的」を同定し、オートファジー阻害効果の分子機構を明らかにします。さらに、同定された分子標的を基に、オートファジー/プロテアソーム同時阻害→不良タンパク質の蓄積→小胞体ストレス誘導性細胞死、に至る“細胞内ネットワーク”を解明し、「小胞体ストレス誘導療法」を分子レベルで実証します。また一方で、米国FDAで承認されているプロテアソーム阻害剤(BZ,
Carfirzomib)と、各種マクロライド系抗生剤との併用による小胞体ストレス誘導性細胞死増強効果について、多発性骨髄腫細胞株を用いた培養実験ならびに、多発性骨髄腫モデルマウス(NOG-hMMなど)を用いた動物実験により検証し、臨床応用に向けた検討を行います。
社会的意義
社会の高齢化に伴い増加傾向にある難治性多発性骨髄腫について、治療成績の向上は重要な課題です。新薬の開発には莫大な予算とリスクが伴い、前臨床試験から第I~III相臨床試験を経て承認に至る確率は極めて低いのが現状です。本プロジェクトで使用するマクロライド系抗生剤は、これまで臨床現場で使用され続け、体内動態や副作用情報は十分に蓄積されています。“Drug
Re-positioning”の観点からも、マクロライド系抗生剤の分子標的が同定され、かつ動物実験で治療効果が検証されれば、臨床試験への移行は比較的容易です。難治性多発性骨髄腫の治療成績の向上に寄与できれば、費用対効果および社会貢献度は極めて高いと考えられます。
用語解説
多発性骨髄腫:単クローン性γ-グロブリンの産生・分泌を特徴とする難治性腫瘍の一つである。近年、プロテアソーム阻害剤ボルテゾミブやサリドマイド誘導体のレナリドミドが米国FDAならびに本邦で認可され、第一選択治療として長年実施されてきたメルファラン/プレドニゾロン療法を上回る治療成績が期待されているが、生存期間の中央値は56ヵ月と未だ“不治”の造血器腫瘍の一つである。
タンパク質分解系:オートファジー・リソソーム系と、ユビキチン・プロテアソーム系とが、細胞におけるタンパク質の二大分解系である。ユビキチン・プロテアソーム系では、ユビキチンリガーゼ複合体によってユビキチン化を受けた特定タンパク質が、26Sプロテアソームに運ばれ分解される。オートファジーは下記参照。近年、これら二大分解系のクロストークについても、解析が進められている。
オートファジー:細胞内タンパクや小器官を二重の脂質膜で包み込み,これをリソソームに輸送し分解する一連のプロセスである。当初は栄養飢餓時などにおける非選択的な分解と考えられていたが、昨今は特定タンパク質の分解など選択性にも注目が集まる。オートファジーが阻害されると、不要なタンパク質や不良な細胞内小器官が細胞内に蓄積し、神経変性など各種疾患の原因になると考えられている。
小胞体ストレス:小胞体は分泌タンパク質、膜タンパク質の成熟の場である。様々な要因により、折りたたみ不良タンパク質が小胞体内に過度に蓄積することで、小胞体ストレスが引き起こされる。細胞は、タンパク質合成の抑制、不良タンパク質の分解促進といったストレス応答機構を有するが、ストレスが回避できない場合には、細胞死を引き起こす。したがって小胞体ストレスの人為的な誘導は、がん治療に繋がると期待される。
その他
当研究チームでは下記の化合物についても、オートファジー、小胞体ストレス、細胞死あるいは代謝調節に関する解析を進めています。
・メシル酸イマチニブ
・ビタミンK2
・ニコチンアミド
・ハルモール
・フェノキサジン
参考文献
1. Clarithromycin enhances bortezomib-induced cytotoxicity via endoplasmic reticulum stress-mediated CHOP (GADD153) induction and autophagy in breast cancer cells. Komatsu S, Miyazawa K, Moriya S, Takase A, Naito M, Inazu M, Kohno N, Itoh M, Tomoda A. Int J Oncol. 2012 Apr;40(4):1029-39.
2. Macrolide antibiotics block autophagy flux and sensitize to bortezomib via endoplasmic reticulum stress-mediated CHOP induction in myeloma cells. Moriya S, Che XF, Komatsu S, Abe A, Kawaguchi T, Gotoh A, Inazu M, Tomoda A, Miyazawa K. Int J Oncol. 2013 May;42(5):1541-50.
3. Combined treatment with SAHA, bortezomib, and clarithromycin for concomitant targeting of aggresome formation and intracellular proteolytic pathways enhances ER stress-mediated cell death in breast cancer cells. Komatsu S, Moriya S, Che XF, Yokoyama T, Kohno N, Miyazawa K. Biochem Biophys Res Commun. 2013 Jul 19;437(1):41-7.
バナースペース
東京医科大学 分子標的探索センター
[事務室]
〒160-8402
東京都新宿区新宿6-1-1
第一校舎 一階 生化学研究室内
TEL 03-3351-6141 (内線:244)
FAX 03-3351-6466