研究概要
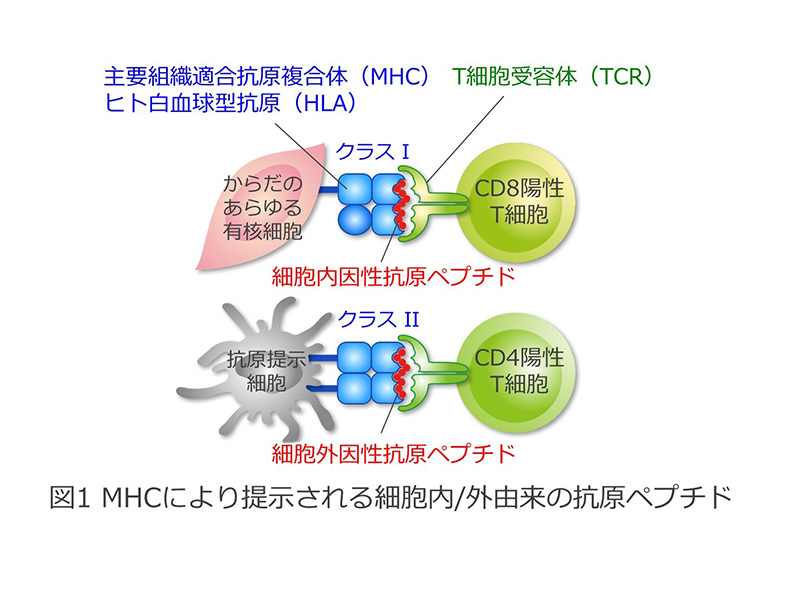
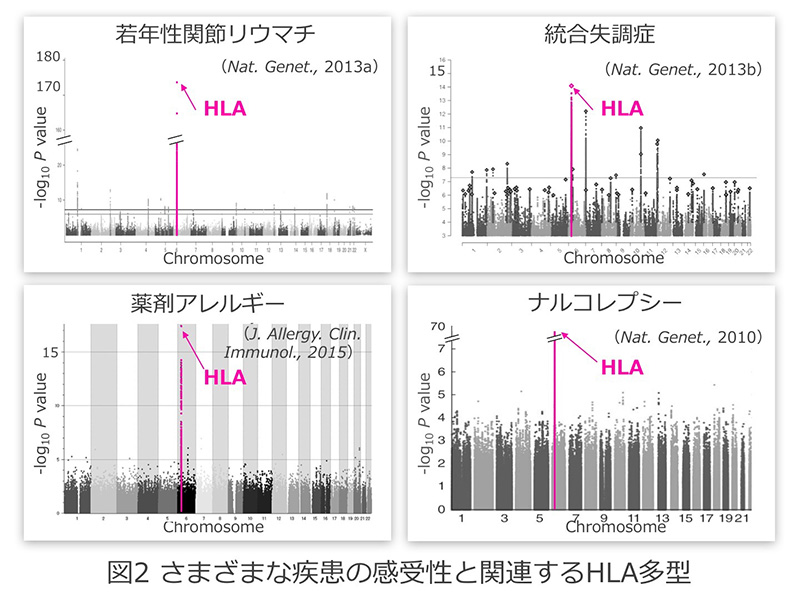
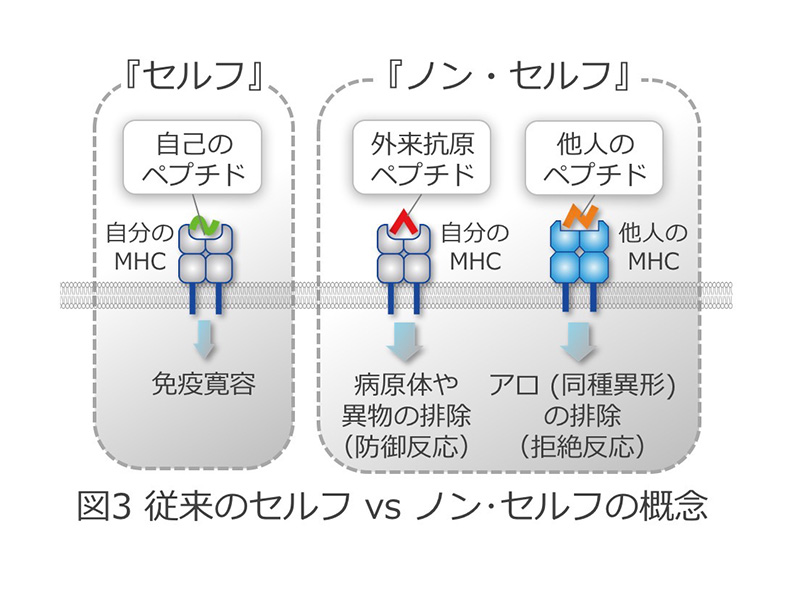
主要組織適合抗原複合体(Major Histocompatibility Complex: MHC、ヒトではHuman Leukocyte Antigen: HLAと呼びます)は、免疫応答を担う中心分子として長年研究され、1980年と1996年の2回にわたりノーベル賞医学生理学賞の対象となりました。MHCが自身の溝に何をのせるかによって免疫応答は規定され、特に「自己(セルフ)」あるいは「非自己(ノン・セルフ)」のペプチドとの結合・提示が免疫応答を制御します(図1)。疾患との関わりからは、自己免疫疾患=「セルフの誤認」、アレルギー=「ノン・セルフに対する過剰応答」と位置づけられ、これらの病態の研究が行われてきました。また一方、最近のヒトゲノム解析の進展によって、様々な遺伝子が自己免疫疾患やアレルギーの発症に関与していることが明らかになってきましたが、関節リウマチなどの自己免疫疾患やアレルギー性疾患はもとより、精神神経疾患や代謝疾患などこれまで免疫(分子)が病態の中心であると考えられてこなかったものも含め、MHCが多くの疾患の感受性に最も強い影響を与える遺伝子であることが分かりました(図2)。しかし、なぜMHCアリルの違いが疾患発症と関連するのか、従来の「セルフとノン・セルフとの識別」だけでは解明することはできませんでした(図3)。平成22~26年度新学術領域研究「HLA進化と疾病」(http://hp.hla-singakujyutsu.jp)では、これらの課題の解決に取り組んできました。その結果、「セルフ」と「ノン・セルフ」という概念だけでは不十分であり、新たに「ネオ・セルフ」という認識概念を創出する必要が生じてきました。すなわち、従来の、「セルフ」、「ノン・セルフ」の定義では理解が困難であった免疫認識機構に、「ネオ・セルフ」という新たな概念を打ち立てることによって、自己免疫疾患やアレルギー、本来自己の細胞である腫瘍細胞に対する免疫応答の基本メカニズムを理解できるという考えに至りました。
※クリックで図を拡大できます
「ネオ・セルフ」とは?
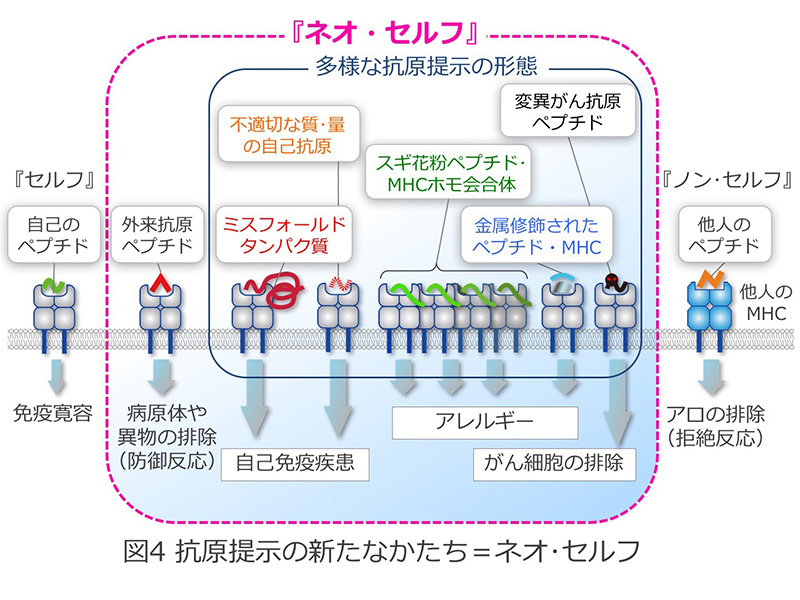
自己免疫疾患、およびアレルギーは、それぞれ「セルフ」あるいは「ノン・セルフ」に対する異常免疫応答と考えられてきました。こうした異常免疫応答のメカニズムを解明することが免疫疾患の原因を究明する上できわめて重要です。新学術領域研究「HLA進化と疾病」により、MHC-抗原ペプチド複合体が通常とは異なる構造をとることで、自己免疫疾患やアレルギーの標的になっていることを明らかにしました。すなわち、自己のMHCは抗原(ペプチド)を提示するだけではなく、MHC-抗原複合体が多種多様な構造をとることで、さまざまな免疫応答を惹起しているということです。具体的には、図4に示しますように、MHC-抗原ペプチド複合体が多量体を形成したり、抗原が金属や薬剤で修飾されたり、抗原蛋白質が変性したりすることによって、抗原が、従来のペプチドとは異なった形でMHCに提示され、免疫細胞に認識されています。このようなMHC-抗原複合体の質的・量的な変化によって引き起こされる免疫応答は、従来の「セルフ」、「ノン・セルフ」という抗原の分類では十分に説明できません(図3)。本新学術領域では、質的・量的に「セルフ」と異なる分子とMHC(HLA)の複合体を新たに「ネオ・セルフ」と定義します(図4)。
本研究領域の方向性
本領域では、自己の組織に対する免疫応答(自己免疫)の異質性を探求するのではなく、病態において免疫応答の引き金となる抗原を、「完璧な」セルフとは異なるネオ・セルフと捉えることにより、長らく不明であった自己免疫疾患やアレルギーの多角的な病態解明のみならず、腫瘍細胞に対する免疫応答を効果的に誘導するための技術基盤の構築を目指します。
本領域の目標達成のために、構造生物学、分子進化学、ゲノミクス・プロテオミクス、イメージング、1細胞解析等の先端的な技術を有する研究者が集い、総括班の指揮下に、これらの技術と以下のような各研究班が有機的に結びついた体制で臨みます。詳細は各研究班の紹介ページをご覧下さい。
