平成29~30年度 公募研究紹介
▼公募研究A01 ネオ・セルフの機能的理解 ▼公募研究A02 ネオ・セルフの構造的理解
公募研究A01 ネオ・セルフの機能的理解
TRIMファミリータンパク質による抗原提示制御
| 研究代表者 |  |
畠山 鎮次 |
北海道大学 大学院医学研究院 生化学分野 教授 研究室HPへ(https://hokudai-ikagaku.jp/) |
| 連携研究者 | 高橋 秀尚 | 北海道大学 大学院医学研究院 生化学分野 講師 | |
| 連携研究者 | 渡部 昌 | 北海道大学 大学院医学研究院 生化学分野 助教 |
畠山班 研究概要
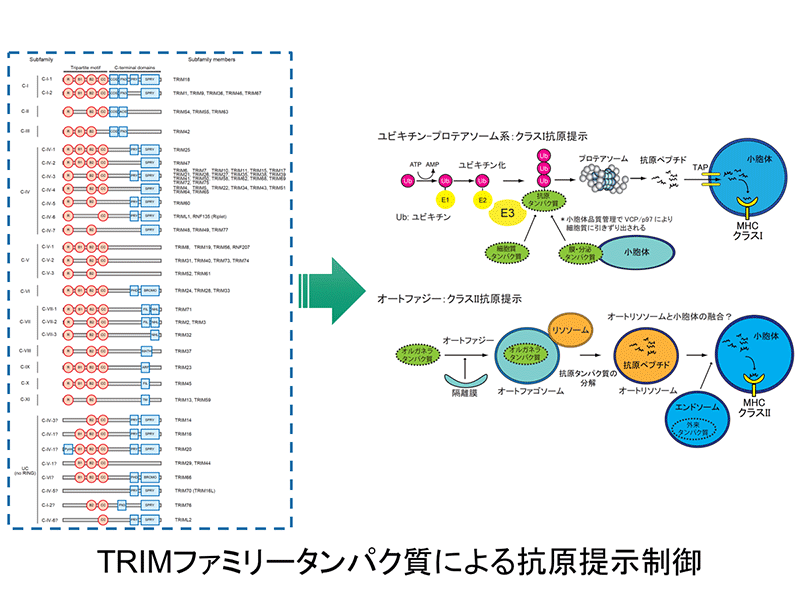
免疫担当細胞のシグナル伝達過程において、リン酸化、アセチル化、ユビキチン化などのタンパク質翻訳後修飾が重要な役割を果たしています。免疫疾患の発症において、獲得免疫を担当するT細胞やB細胞による「新規自己抗原(ネオセルフ抗原)」の認識が関与している可能性があります。細胞質に存在するタンパク質の多くは「ユビキチン-プロテアソーム系」で分解され、その一部が小胞体に入り、MHCクラスI上に抗原ペプチドとして提示されます。一方、細胞内の小胞を含むオルガネラは「オートファジー」システムによりバルクの分解を受け、小胞体に入り、一部はMHCクラスII上に抗原ペプチドとして提示されます。オートファジーの制御に、E3ユビキチンリガーゼであるTRIMタンパク質ファミリーが関与することが知られています。本研究では、両プロセスにおけるユビキチン化酵素群、特にTRIMファミリーの関与を検討します。
Trends Biochem Sci. 42(4):297-311, 2017. doi: 10.1016/j.tibs.2017.01.002.
Nature Commun. 6:7299, 2015. doi: 10.1038/ncomms8299.
Nature Rev Cancer. 11(11):729-804, 2011. doi: 10.1038/nrc3139.
HLA型に基づく経皮感作小麦アレルギー関連ペプチドの同定
| 研究代表者 |  |
野口 恵美子 | 筑波大学 医学医療系 遺伝医学 教授 研究室HPへ(http://www.md.tsukuba.ac.jp/basic-med/m-genetics) |
| 連携研究者 | 広川 貴次 | 国立研究開発法人 産業技術総合研究所 創薬分子プロファイリング研究センター 研究チーム長 |
|
| 連携研究者 | 宮寺 浩子 | 筑波大学 医学医療系 遺伝医学 助教 | |
| 連携研究者 | 松永 佳世子 | 藤田保健衛生大学 医学部 アレルギー疾患対策医療学講座 教授 | |
| 連携研究者 | 中村 政志 | 藤田保健衛生大学 医学部 アレルギー疾患対策医療学講座 客員講師 |
野口班 研究概要
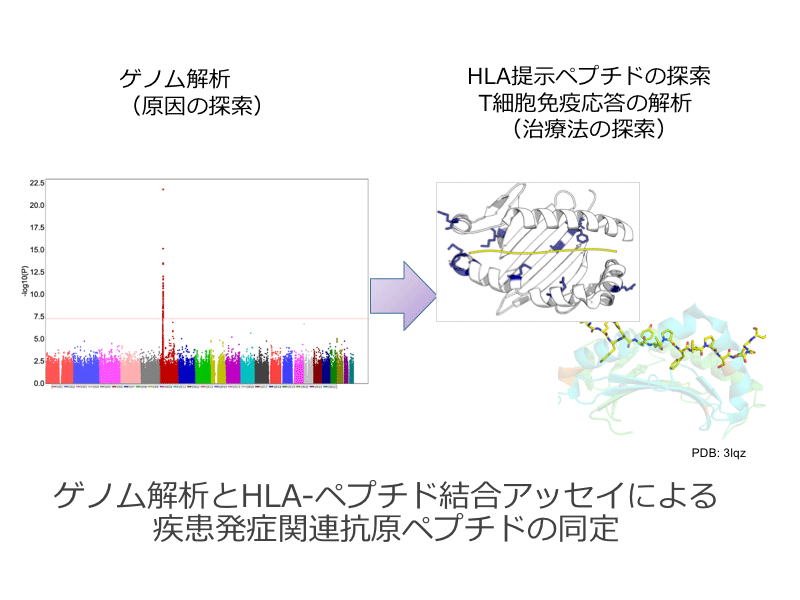
近年、加水分解小麦含有石鹸を使用したのちに重度の食物(小麦)アレルギーを発症した症例が本邦において2000例以上報告され、世界的にも注目されています。この経皮感作小麦アレルギーの症例を用いた全ゲノム関連解析(Genome-wide association study, GWAS)では、HLA class II領域に強い関連が認められました。さらに私たちはHLA-Class IIアレルについてPCR-SSOP法による実タイピングを行い疾患感受性アレルと抵抗性アレルを同定しました。本研究計画ではこれらの結果に基づいて、経皮感作小麦アレルギー患者の実タイピングデータ及びGWAS SNPタイピングデータを用いてHLA領域の疾患感受性/抵抗性に関するマップを作製します。疾患感受性/抵抗性アレルとペプチド候補情報を用いたIn silico 解析により選定された候補ペプチドについて、組換えHLAタンパク質との結合解析を行うことにより、疾患発症に関与しうる抗原ペプチド領域を同定することを目的とします。
Allergy. 71(10):1486-89, 2016. doi: 10.1111/all.12950
Vaccine. 35(4):703-710, 2017. doi: 10.1016/j.vaccine.2016.08.068
J Allergy Clin Immunol Pract. 4(3):481-488.e2, 2017 doi: 10.1016/j.jaip.2016.01.012
アンコンベンショナルT細胞の分化と機能におけるネオ・セルフ抗原の関与とその役割
| 研究代表者 |  |
木村 元子 | 千葉大学 大学院医学研究院 免疫発生学 准教授 研究室HPへ(http://www.m.chiba-u.ac.jp/class/meneki/member/member_kimura.html) |
木村班 研究概要
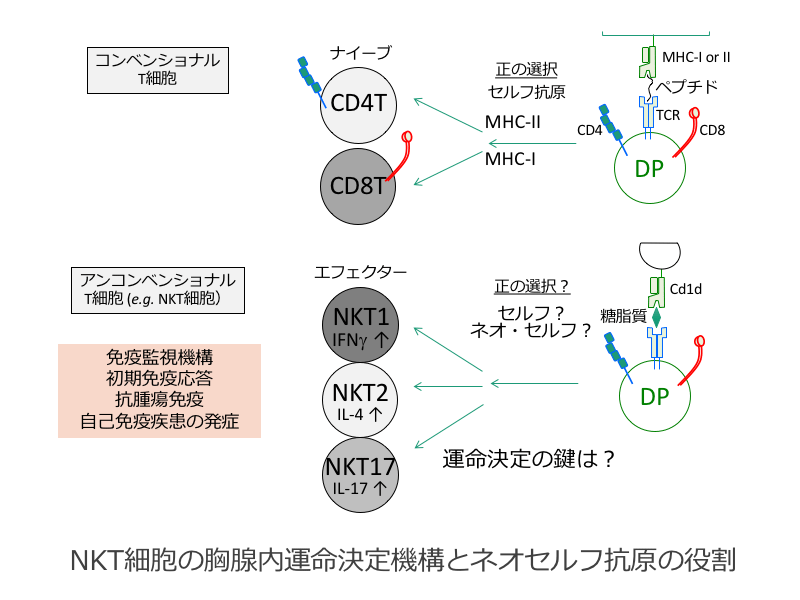
生体内には、多様性の乏しい抗原受容体を有するアンコンベンショナルT(Tunconv)細胞が少数ながら存在します。このTunconv細胞は、胸腺内でエフェクター機能を有する細胞へと分化成熟し、感染時の初期免疫応答や抗腫瘍免疫などの生体の免疫監視機構を担うほか、自己免疫疾患の発症にも関わることが示唆されています。しかしTunconv細胞が胸腺内でどのような抗原によって正の選択を受け分化し、エフェクター機能を有する細胞へと成熟するのか、その機構はよくわかっていません。T細胞が胸腺内で分化成熟するためには通常生体由来のセルフ抗原が必要ですが、Tunconv細胞の認識する抗原の多くは、特定の糖脂質や代謝産物などの細菌由来であることから、これらの外来由来のネオ・セルフ抗原を胸腺内で認識している可能性も考えられます。本研究では、Tunconv細胞、特にナチュラルキラーT(NKT)細胞の胸腺内分化機構と、分化に関わるシグナルの質的な違いを明らかにすることを目的としています。
Nat Immunol. 17(12):1415-23, 2016. doi: 10.1038/ni.3560.
Sci Immunol. 1:eaaf9154, 2016.
Nat Immunol. 16(5):517-24, 2015. doi: 10.1038/ni.3146.
胸腺ネオ・セルフ抗原によるT細胞免疫系の制御
| 研究代表者 |  |
新田 剛 | 東京大学 大学院医学系研究科 免疫学 准教授 研究室HPへ(http://osteoimmunology.com/research.html) |
| 連携研究者 | 高柳 広 | 東京大学 大学院医学系研究科 免疫学 教授 |
新田班 研究概要
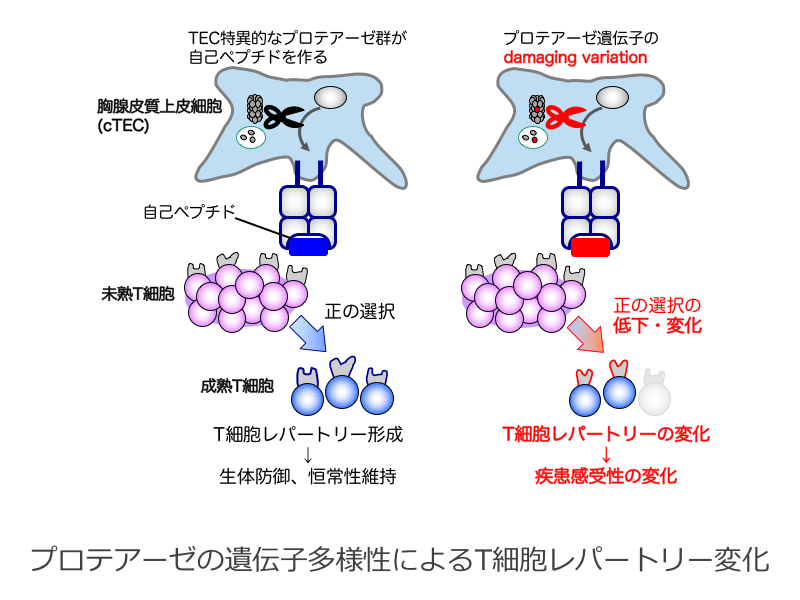
T細胞の抗原認識レパートリーは、胸腺内に提示された自己ペプチドの認識にもとづく正/負の選択を通して形成されます。胸腺皮質上皮細胞は、T細胞の正の選択に必要な自己ペプチドを生成するプロテアーゼ群を発現しています。私たちは、独自収集したヒトゲノム情報から、胸腺皮質上皮細胞特異的なプロテアーゼ遺伝子群に、機能に影響を与える遺伝子多様性(damaging variation)が多く存在することを見出しました。さらに、これらのvariationの一部は、マウスにおいてT細胞の生成を低下させることがわかりました。本研究では、プロテアーゼ遺伝子群のvariationが胸腺内の自己ペプチド生成を変化させ、T細胞レパートリーの変容と疾患感受性の変化をもたらす可能性を検証します。この研究によって、T細胞の「自己・非自己」識別の分子基盤を理解し、病気の原因となる新たな遺伝要素を明らかにできると考えています。
Sci Immunol. 2: eaan5165, 2017. doi: 10.1126/sciimmunol.aan5165.
EMBO Rep. 16(5): 638-53, 2015. doi: 10.15252/embr.201540096
Immunity. 32(1): 29-40, 2010. doi: 10.1016/j.immuni.2009
制御性T細胞による組織特異的自己免疫寛容誘導・維持機構の解明
| 研究代表者 |  |
堀 昌平 | 東京大学 大学院薬学系研究科 免疫・微生物学教室 教授 研究室HPへ(http://www.f.u-tokyo.ac.jp/~bisei/) |
| 連携研究者 | 城口 克之 | 理化学研究所 生命システム研究センター オミックス動態研究ユニット ユニットリーダー |
堀班 研究概要
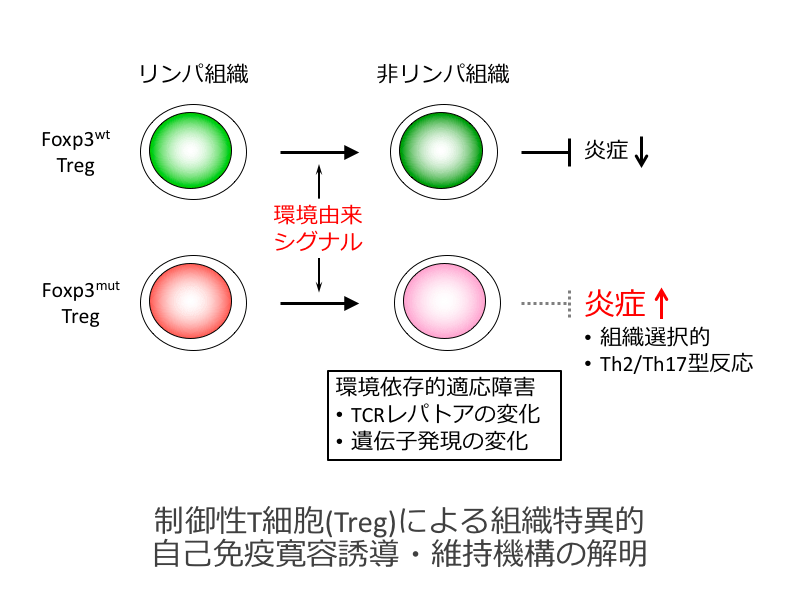
転写因子FoxP3を発現する制御性T細胞(Treg)は免疫応答を負に制御することで自己免疫、炎症、アレルギーなど様々な病的免疫応答を抑制し、自己免疫寛容に必須の役割を担っています。Tregは時々刻々変化する組織環境、炎症環境に適応することで機能し、この“適応性”がTregによる免疫制御に重要です。我々は、ヒト自己免疫疾患IPEXにおいて同定されているFoxP3変異を導入したマウスモデルを作製・解析する過程で、特定の組織環境、炎症環境におけるTregの適応性を障害することで組織選択的かつTh2及びTh17型反応に偏った自己免疫疾患を惹起するミスセンス変異を同定しました。本研究は、この発見を手がかりとして、「セルフ」および「ネオ・セルフ」に対する免疫寛容を成立させるTregの組織選択的、炎症環境選択的適応機構を明らかにすることを目指します。
Immunity. 47(2):268-283, 2017. doi:10.1016/j.immuni.2017.07.008.
Immunol Rev. 259(1):159-72, 2014. doi: 10.1111/imr.12175.
Immunity. 36(2):262-75, 2012. doi: 10.1016/j.immuni.2011.12.012.
エンドサイトーシスによって生成するネオ・セルフへの免疫応答
| 研究代表者 |  |
鍔田 武志 | 東京医科歯科大学 難治疾患研究所 免疫疾患分野 教授 研究室HPへ(http://www.tmd.ac.jp/mri/section/pathophysiology/imm/) |
鍔田班 研究概要
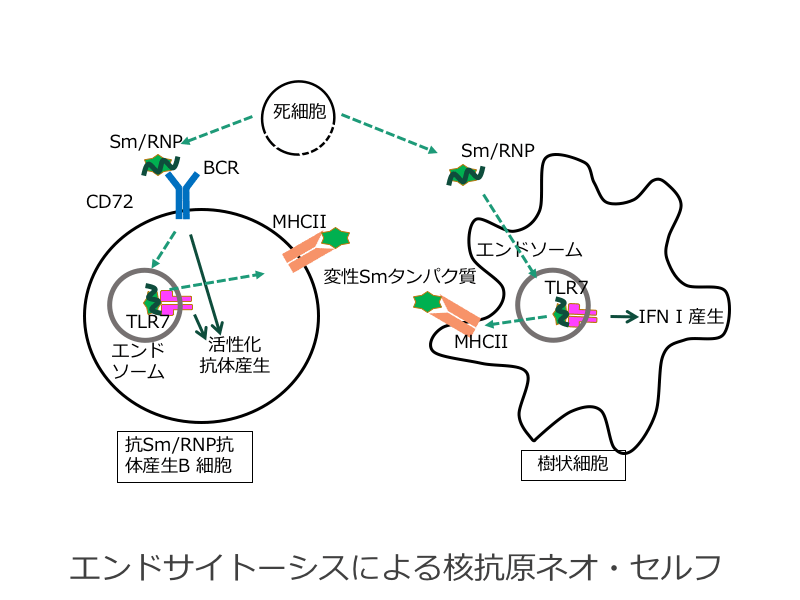
全身性エリテマトーデス(SLE)は代表的な全身性自己免疫疾患で、種々の核抗原への自己抗体が産生されるが、発症早期には主にヌクレオソームやSm/RNPなどの核酸と核タンパク質の複合体に対する自己抗体が産生され、とりわけSm/RNPなどのRNA関連自己抗原への免疫応答はSLE発症で重要である。核タンパク質にはヒストンのように天然変性タンパク質が多く、また、Sm抗原も複合体では安定であるが、ばらばらにすると速やかに変性する。そこで、本研究ではBリンパ球や樹状細胞でのエンドサイトーシス由来の変性Smタンパク質がSLEでの自己抗体産生でどのような役割を果たすか解明する。
J Exp Med. 213(12):2691-2706, 2016. doi: 10.1084/jem.20160560
J Immunol. 190(7):3189-96, 2013. doi: 10.4049/jimmunol.1203364
Proc Natl Acad Sci USA. 109(20):7811-16, 2012. doi: 10.1073/pnas.1204509109
新たな抗原レパートリー「リポペプチド」の生成・認識機構の解明
| 研究代表者 |  |
杉田 昌彦 | 京都大学 ウイルス・再生医科学研究所 細胞制御研究分野 教授 研究室HPへ(http://www.virus.kyoto-u.ac.jp/Lab/SugitaLab.html) |
杉田班 研究概要
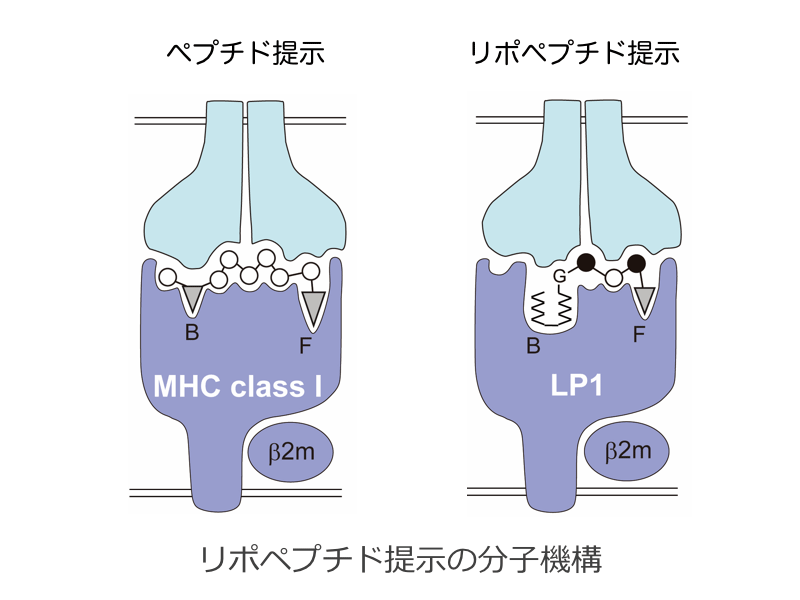
獲得免疫は、MHC分子がペプチド抗原をT細胞に提示することにより誘起されると考えられてきました。これに対して、私たちの最新の研究から、「リポペプチド」抗原を標的とした新しいT細胞応答の存在が明らかとなってきました。タンパク質のミリスチン酸修飾に由来するこの新しい免疫標的分子は、4〜5個のアミノ酸残基よりなる短いペプチド鎖のN末端グリシンにC14直鎖飽和脂肪酸(ミリスチン酸)が付加されたものであり、従来知られている免疫標的とは異質のものです。興味深いことに、MHCクラス1分子がリポペプチド提示分子(LP1)として機能することが、アカゲザルエイズモデルを活用した解析から明らかとなりました。すなわち、「MHCクラス1分子によるリポペプチド抗原提示」という新しい免疫パラダイムが想定されます。本研究では、細胞生物学的また構造生物学的解析を駆使して、この新免疫パラダイムの確立を目指します。
Nat Commun. 7:10356, 2016. doi: 10.1038/ncomms10356.
Immunology. 149(2):139-45, 2016. doi: 10.1111/imm.12646.
腫瘍浸潤リンパ球中のネオアンチゲン特異的CTLクローンの頻度計測と特性の解析
| 研究代表者 |  |
河本 宏 | 京都大学 ウイルス・再生医科学研究所 再生免疫学分野 教授 研究室HPへ(http://kawamoto.frontier.kyoto-u.ac.jp/) |
河本班 研究概要
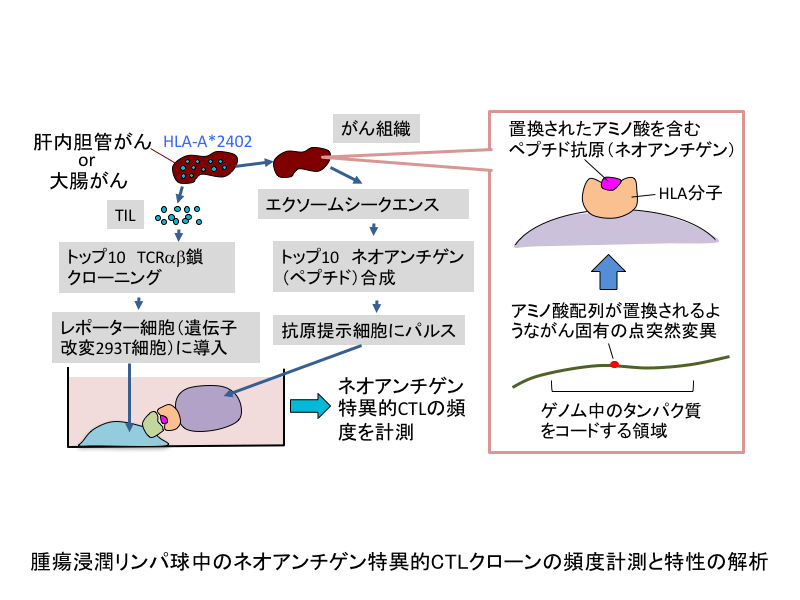
本申請研究は、「ネオアンチゲン特異的な細胞傷害性T 細胞(CTL)はそもそもがん患者にどれくらい存在するのか」という問題に取り組みます。免疫チェックポイント阻害剤のような非特異的な免疫の活性化によるがん免疫療法で標的となる抗原には、がん細胞に固有の変異によって生じた変異抗原、いわゆる「ネオアンチゲン」が含まれていると考えられます。しかし、これまでに腫瘍浸潤リンパ球(TIL)中のネオアンチゲン特異的なCTLの頻度についてはほとんど報告されていませんでした。本研究では、TIL中のネオアンチゲン特異的なCTLの頻度を計測し、さらにそれらのがん細胞の殺傷能力を検定することを目的とします。具体的には、肝内胆管がんあるいは大腸がんを対象に、TILからTCR遺伝子をクローニングし、ネオアンチゲンに特異的なTCRの頻度を計測、さらにそのTCRを遺伝子導入して作製した再生CTLの細胞傷害活性を測定します。
Cancer Research. 76(23):6839-50, 2016. doi: 10.1158/0008-5472.CAN-16-1149.
Cell Stem Cell. 12(1): 31-6. 2013. 10.1016/j.stem.2012.12.006.
Science. 329(5987): 93-6, 2010. doi: 10.1126/science.1188995.
ネオセルフ化ペプチドによる新規免疫制御機構の解明
| 研究代表者 |  |
荒瀬 尚 | 大阪大学 微生物病研究所 免疫化学分野 教授 研究室HPへ(http://immchem.biken.osaka-u.ac.jp/) |
| 連携研究者 | 岸田 一輝 | 大阪大学 微生物病研究所 免疫化学分野 特任研究員(常勤) |
荒瀬班 研究概要
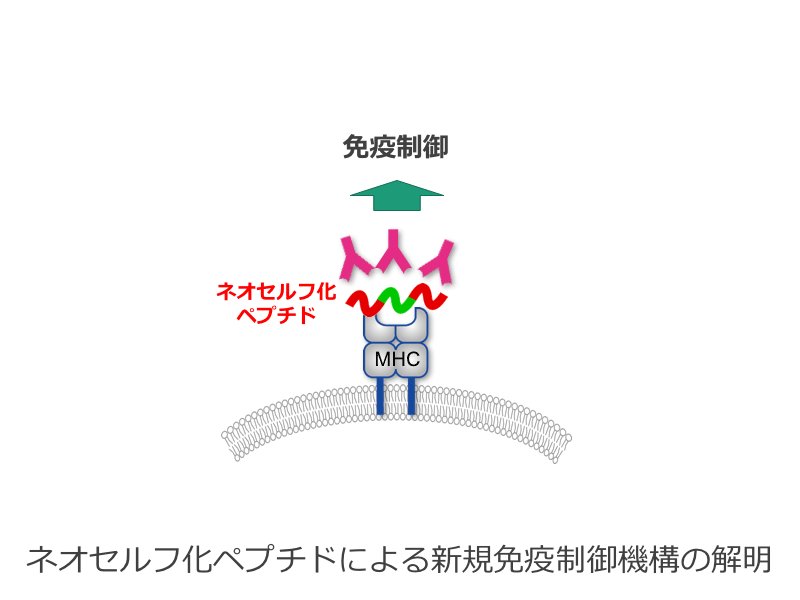
MHCクラスII分子は通常ペプチド抗原をT細胞に提示することで、免疫応答の中心的な役割を担っている。ところが、我々は、MHCクラスII分子は、提示する抗原によっては、抗原特異的なB細胞を直接活性化し、抗体産生に関与していることを明らかにしてきた。そこで、本研究ではMHCクラスII分子によって提示された抗原に対する抗体産生が免疫応答においてどのような機能を担っているかを明らかにする。
Adv Immunol. 129:1-23, 2016. doi: 10.1016/bs.ai.2015.09.005.
Blood. 125(18):2835-44, 2015. doi: 10.1182/blood-2014-08-593624.
Proc Natl Acad Sci USA. 111(10):3787-92, 2014. doi: 10.1073/pnas.1401105111.
細胞老化によるネオ・セルフ生成の分子機構解明
| 研究代表者 |  |
山下 政克 | 愛媛大学 大学院医学系研究科 免疫学 教授 研究室HPへ(http://ehime-u-immunology.com/) |
| 連携研究者 | 桑原 誠 | 愛媛大学 大学院医学系研究科 免疫学助教 | |
| 連携研究者 | 鈴木 淳平 | 愛媛大学 大学院医学系研究科 免疫学助教 |
山下班 研究概要
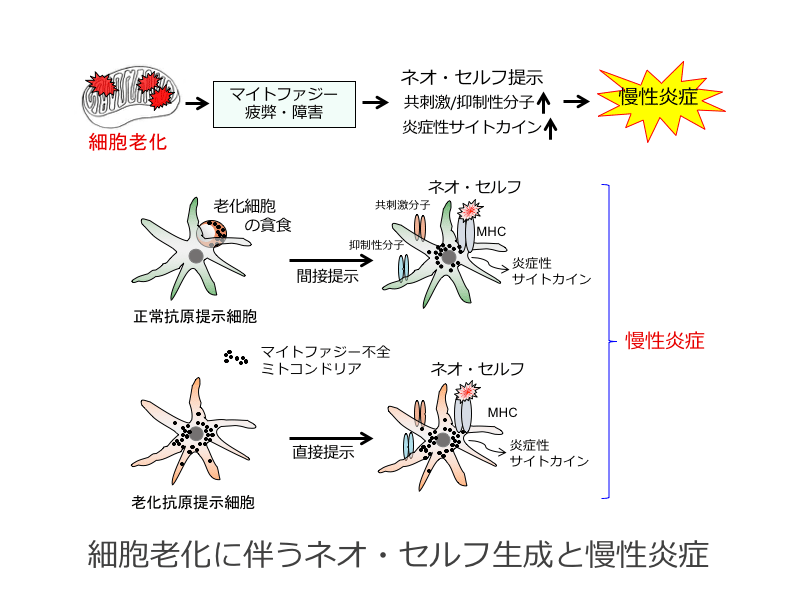
加齢に伴う自己免疫疾患などの加齢関連疾患の増加には、細胞老化が密接に関係している。細胞老化は、ミトコンドリア機能の障害が一因となり引き起こされる。ミトコンドリア障害は、ミトコンドリアDNA(mtDNA)の易変異性とマイトファジー不全が原因となり誘導される。そこで私たちは、細胞老化に伴うmtDNA変異とマイトファジー不全が協調してネオ・セルフ生成を誘導し、加齢に伴う自己免疫疾患の増加を引き起こしている可能性を考えた。また、mtDNA/RNAがファゴゾーム内のTLR刺激を介してSASPやMHC/共刺激分子の発現上昇を誘導し、それが自己免疫疾患発症を促進することも想定している。そこで、これらの仮説を実証するための研究を行い、細胞老化に伴うミトコンドリア障害によるネオ・セルフ生成誘導を介した自己免疫疾患発症という新規概念の確立を目指す。
Nat Commun. 7:12596-08, 2016. doi: 10.1038/ncomms12596.
J Immunol. 197(10):4079-89, 2016. doi: 10.4049/jimmunol.1502295.
Nat Commun. 5:3555-66, 2014. doi: 10.1038/ncomms4555.
紫外線で誘導されるネオ・セルフと制御性T細胞による自己免疫治療法の開発
| 研究代表者 |  |
山崎 小百合 | 名古屋市立大学 大学院医学研究科 免疫学 教授 研究室HPへ(http://www.med.nagoya-cu.ac.jp/immunol.dir/) |
| 連携研究者 | 森田 明理 | 名古屋市立大学 大学院医学研究科 加齢環境皮膚科学 教授 |
山崎班 研究概要
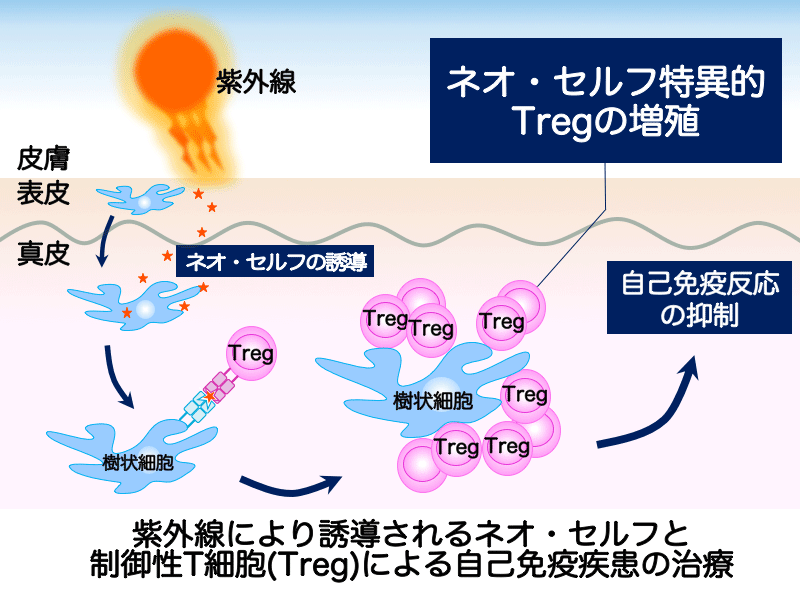
制御性T細胞は、ヒトやマウスの末梢CD4+T細胞の5-10%を占め、自己免疫疾患の発症やその他の重要な免疫反応を抑制しています。私たちは、最近、紫外線照射により制御性T細胞が皮膚のCD4+T細胞の約60%にも増えることを見出しました。紫外線照射にて皮膚で増える制御性T細胞は、紫外線により皮膚からレリースされた自己抗原、つまり、当該領域の課題である「ネオ・セルフ」を認識して増え、自己免疫疾患の発症を抑制していると示唆されます。この際、紫外線でダメージを受けた皮膚から誘導された「ネオ・セルフ」抗原は、プロフェッショナルな抗原提示細胞である樹状細胞により効率よく抗原提示されると考えます。本研究にてこれらを証明し、紫外線で誘導される「ネオ・セルフ」と制御性T細胞による新しい自己免疫治療法への貢献を目指します。
J Immunol. 193(11):5488-97, 2014. doi: 10.4049/jimmunol.1400985.
PLoSOne. 7(12): e51665, 2012. doi: 10.1371/journal.pone.0051665.
J Immunol. 181(10):6923-33, 2008.
ネオ・セルフ生成機構としての免疫プロテアソームの機能的意義
| 研究代表者 |  |
改正 恒康 | 和歌山県立医科大学 先端医学研究所 生体調節機構研究部 教授 研究室HPへ(http://www.wakayama-med.ac.jp/med/seitai/) |
| 連携研究者 | 金澤 伸雄 | 和歌山県立医科大学 医学部 皮膚科学教室 准教授 |
改正班 研究概要
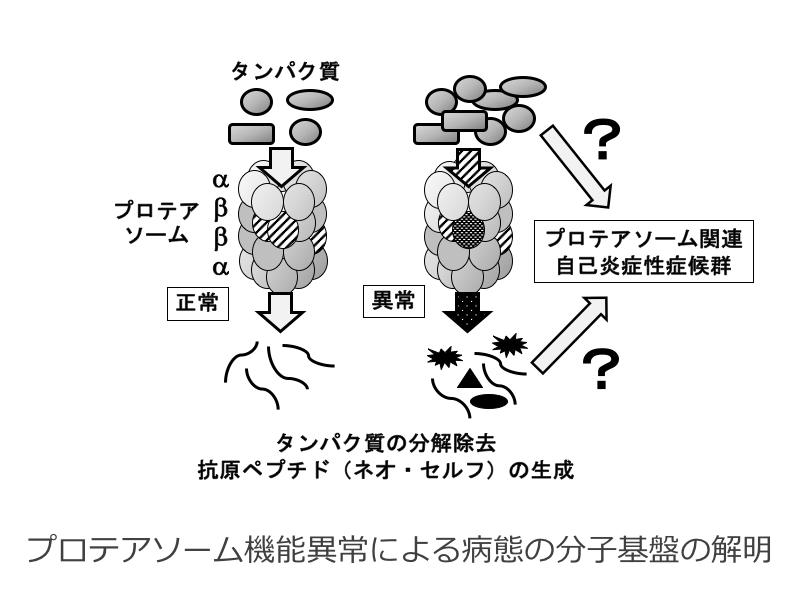
プロテアソームは、不要または不良のタンパク質の分解除去ばかりでなく、抗原ペプチドの形成にも関与するタンパク質複合体であり、ネオ・セルフの生成に重要な機能を果たしていると考えられる。プロテアソーム構成分子の遺伝的異常により生じる慢性難治性炎症はプロテアソーム関連自己炎症性症候群(Proteasome-associated autoinflammatory syndrome、PRAAS)と総称されている。代表的なPRAASとして、プロテアソームサブユニットβ5iのアミノ酸置換変異によって生じる中條西村症候群などが知られているが、その病態の分子基盤についてはほとんど不明である。本研究では、PRAAS患者で認められる変異をマウスに導入することにより、プロテアソームによる恒常性維持及びその破綻の分子機構の解明を進め、ネオ・セルフの生成を制御する機構を明らかにしたいと考えている。
Sci Rep. 6: 23505, 2016. doi: 10.1038/srep23505.
Sci Signal. 7(356):ra119, 2014. doi: 10.1126/scisignal.2005533.
J Immunol. 190(12): 6071-82, 2013. doi: 10.4049/jimmunol.1202798.
ネオセルフ分子群としての脂質抗原の合成と機能解析
| 研究代表者 |  |
藤本 ゆかり | 慶應義塾大学 理工学部 化学科 教授 研究室HPへ(http://www.chem.keio.ac.jp/~fujimoto-lab/) |
| 連携研究者 | 井貫 晋輔 | 慶應義塾大学 理工学部 化学科 助教 |
藤本班 研究概要
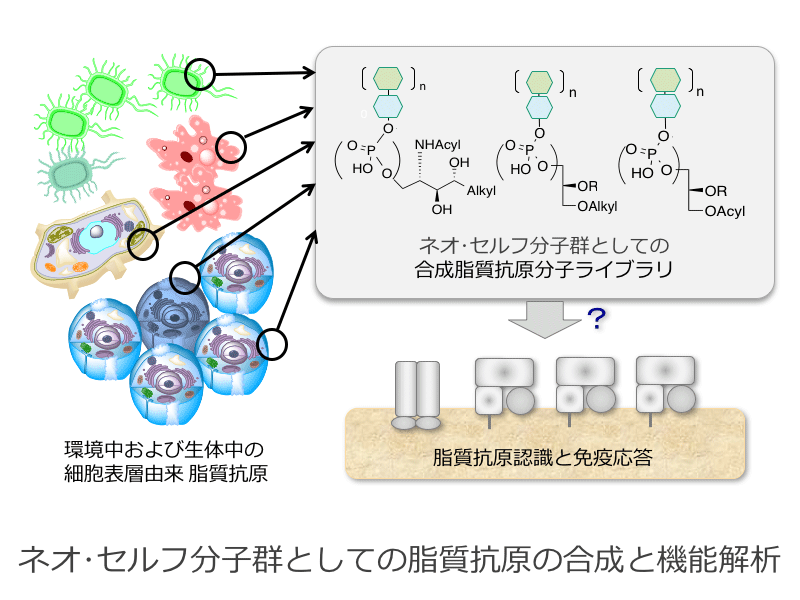
非古典的MHC-1分子である脂質抗原受容体CD1は、種々の外因性、内因性糖脂質等の脂質抗原を認識し免疫機構を調節しており、T細胞を活性化するCD1a-c、CD1e、およびNKT細胞を活性化するCD1dが知られている。CD1dについてはNKT細胞を活性化し、T細胞分化のバランス決定に関わっていることから、創薬を指向した多くの研究が行われているものの、”ネオセルフ”あるいは”セルフ”として自己の抗原認識における本質的な機能は未解明な部分が多い。そこで本研究では免疫バランス調節と環境中・生体内における”ネオセルフ”脂質抗原に着目し、様々な生物種(ヒト(癌細胞関連)、植物(花粉)、線虫、原虫、細菌)由来の脂質抗原構造について、共通構造の統一的合成法と種々の類縁構造を網羅的に合成可能な手法を開発し、化合物ライブラリに基づく”ネオセルフ”抗原の機能解析を目指す。
Chem Eur J. 2017, in press. doi: 10.1002/chem.201701298
ACS Chem Biol. 11(11):3132-39, 2016. doi: 10.1021/6b00674
Org Bioorg Chem. 11(30):5034-41, 2013. doi: 10.1039/C3OB40899J
遺伝子サイレンシング機構の破綻によるネオセルフ生成と、免疫活性化の検証
| 研究代表者 |  |
竹馬 俊介 | 慶應義塾大学 医学部 微生物学・免疫学 講師 研究室HPへ(http://www.maroon.dti.ne.jp/schikuma/) |
竹馬班 研究概要
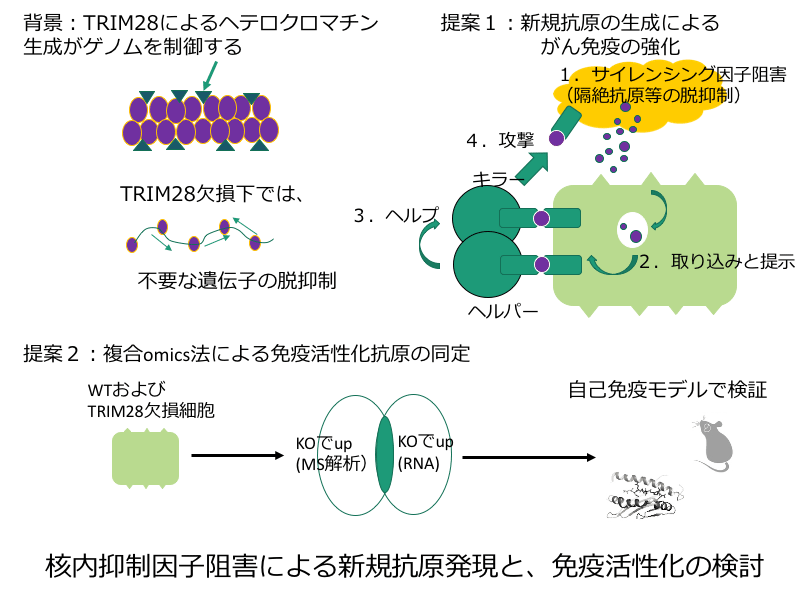
PD-1抗体をはじめとする免疫チェックポイント阻害剤ががんに有効であることが臨床で証明され、免疫系によるがん攻撃機構が治療にも有用であることが明らかとなりました。がんは、遺伝子変異により非自己として認識される新規抗原を表出し、この抗原認識が起こりやすいほど免疫のターゲットとなりやすいことが示されています。当研究では、ゲノム上で不要な遺伝子抑制を行うサイレンシング機構に着目し、これを阻害した結果、脱抑制されて出現する新規自己抗原「ネオセルフ」を、各種オミクスを用いてとらえることを試みます。実験モデルとして、クロマチン結合タンパクであるTRIM28を阻害すると、正常組織に異所性にさまざまな抗原が発現し、免疫系を刺激する可能性を見出しています。これをがん免疫の実験系に応用し、がんの悪性度を上げることなく、その抗原性を増強させることを目指した、新しいコンセプトの免疫療法を開発します。
【参考論文】
Int J Clin Oncol. 21(3):448-55, 2016. doi: 10.1007/s10147-016-0958-0.
Nat Immunol. 14(12):1212-18, 2013. doi: 10.1038/ni.2762.
Nat Immunol. 13(6):596-603, 2012. doi: 10.1038/ni.2293.
ネオセルフとしての消化管抗原に対するT細胞応答制御とNotchシグナルの意義解明
| 研究代表者 |  |
穂積 勝人 | 東海大学 医学部 生体防御学 教授 研究室HPへ(http://hozumi.med.u-tokai.ac.jp/index.html) |
穂積班 研究概要
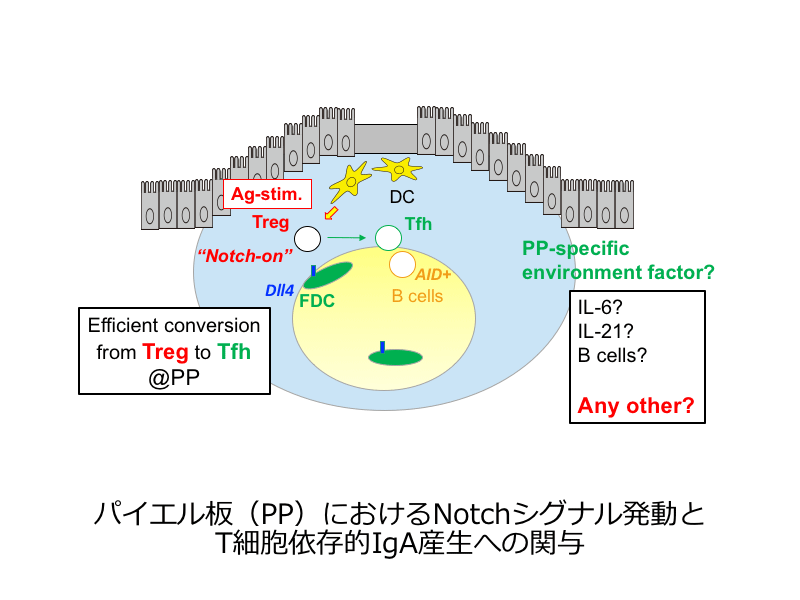
免疫系は、自己と非自己を識別し、非自己を特異的に排除する機能を有するが、「自己ではない」物体として体内に大量に存在する腸内細菌叢および腸管由来抗原への免疫応答は、排除や無反応ではなく、IgAを中心とした「境界の明確化」として発動する。この体内に存在する自己成分ではない消化管抗原(=ネオ・セルフ)への応答性の理解は、炎症性腸疾患等の難治性疾患の新たな治療法の確立にきわめて重要である。
本研究では、消化管抗原(=ネオ・セルフ)応答に強く関与するTreg細胞とIgA産生に重要なTfh細胞の分化について、特にパイエル板(PP)にて特徴的に発動するDll4由来Notchシグナルの観点から、詳細な理解を目指す。
Eur J Immunol. 45(8):2252-62, 2015. doi: 10.1002/eji.201445123.
Genes Cells. 20(6):500-11, 2015. doi: 10.1111/gtc.12243.
J Exp Med. 205(11):2507-13, 2008. doi: 10.1084/jem.20080134.
腫瘍浸潤B細胞がT細胞に提示するがんネオセルフ抗原の同定
| 研究代表者 |  |
北村 大介 | 東京理科大学 生命医科学研究所 分子生物学研究部門 教授 研究室HPへ(http://www.rs.noda.tus.ac.jp/~ribsjm/kitamuralab/indexj.html) |
| 連携研究者 | Nguyen Tien Dat | 東京理科大学 生命医科学研究所 分子生物学研究部門 ポスドク | |
| 連携研究者 | 中面 哲也 | 国立研究開発法人 国立がん研究センター 先端医療開発センター医薬品開発グループ 分野長 |
北村班 研究概要
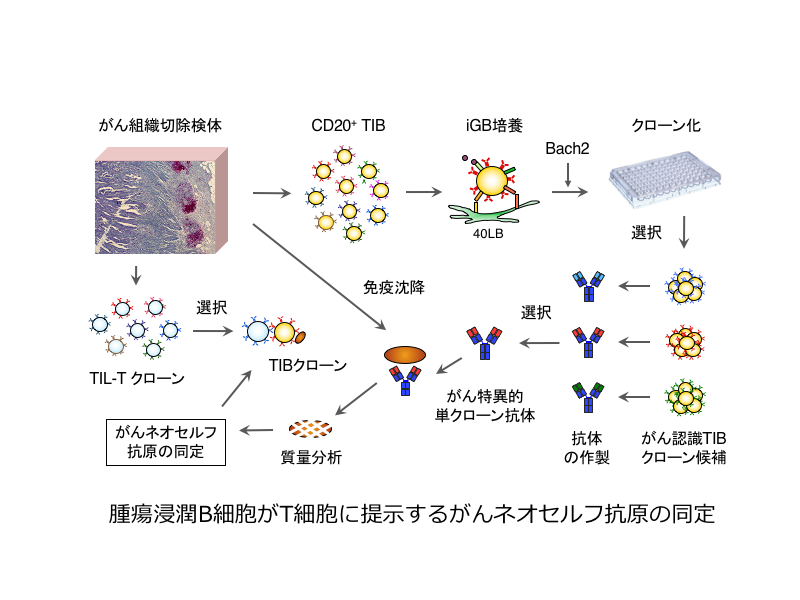
がん細胞に蓄積する遺伝子変異によるタンパクのアミノ酸置換や糖鎖修飾等の異常、また異常発現はネオセルフ抗原を生み出すが、それに対する免疫応答の詳細は不明である。以前より、腫瘍浸潤T細胞(TIL-T)はがん免疫療法に用いられているが、TIL-Tが認識する抗原はあまり知られていない。一方、腫瘍浸潤B細胞(TIB)は、抗原受容体のクラススイッチ・親和性成熟を経ていることからがん抗原に反応し活性化しており、また、がん抗原をT細胞へ提示していると思われる。そこで、TIBをクローン化し、がん特異抗原を認識するものを特定し、その抗原受容体が認識するネオセルフ抗原を同定し、さらに、TIBクローンが提示するネオセルフ抗原を認識するTIL-Tクローンを特定する。この研究によりがんネオセルフ抗原に対する免疫応答の存在を証明し、その抗原認識機構の解明を推進し、新たながん免疫細胞療法や抗体医薬・CARの創出をめざす。
Nat Immunol. 17(9):1109-17, 2016. doi: 10.1038/ni.3508.
PLoS One. 9(3):e92732, 2014. doi: 10.1371/journal.pone.0092732.
Nat Commun. 2:465, 2011. doi: 10.1038/ncomms1475.
ネオ・セルフとして共生する病原微生物が引き起こす病態の解明
| 研究代表者 |  |
田中 芳彦 | 福岡歯科大学 基礎医歯学部門 機能生物学講座教授 研究室HPへ(http://www.fdcnet.ac.jp/col/info/teacher/kouza/kinou.html#kansen) |
| 連携研究者 | 永尾 潤一 | 福岡歯科大学 基礎医歯学部門 機能生物学講座 講師 | |
| 連携研究者 | 成田 由香 | 福岡歯科大学 基礎医歯学部門 機能生物学講座 助教 | |
| 連携研究者 | 有田 健一 | 福岡歯科大学 基礎医歯学部門 機能生物学講座 助教 |
田中班 研究概要
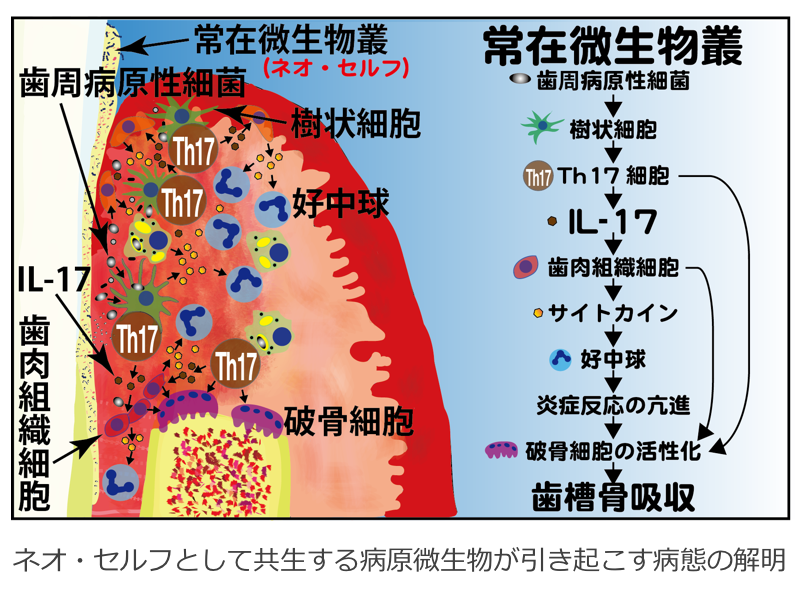
生物は自らの細胞や器官とともに、「共生する微生物」によって生体を構成しています。免疫系は異物を排除するために備わっていますが、共生がどのように維持され、それが破綻して常在微生物による疾患を発症するのかほとんど明らかになっていません。歯周病は口腔内常在細菌によって引き起こされる疾患であり、その病態がTh17細胞を介した免疫応答による歯周囲組織の破壊であることが明らかになってきました。本研究では、最も多種多様な常在微生物叢を形成している口腔を対象に、歯周病を病態モデルとしてネオ・セルフとして共生する微生物と生体における寛容ならびにその破綻のメカニズムを解明することを目指します。これらの情報を基に、共生がどのように維持され、それが破綻して常在微生物による疾患を発症するのかを明らかにして、ネオ・セルフの概念の創出に貢献します。
FEMS Yeast Res. 17(1): fow099, 2017. doi: 10.1093/femsyr/fow099.
Nat Commun. 8:13946, 2017. doi: 10.1038/ncomms13946.
Int J Inflamm. 2017. in press.
ネオ・セルフ抗原認識を細胞分化制御に転換する核内装置の解明
| 研究代表者 |  |
谷内 一郎 | 理化学研究所 統合生命医科学研究センター 免疫転写制御研究グループ グループディレクター 研究室HPへ(http://www.ims.riken.jp/labo/20/) |
谷内班 研究概要
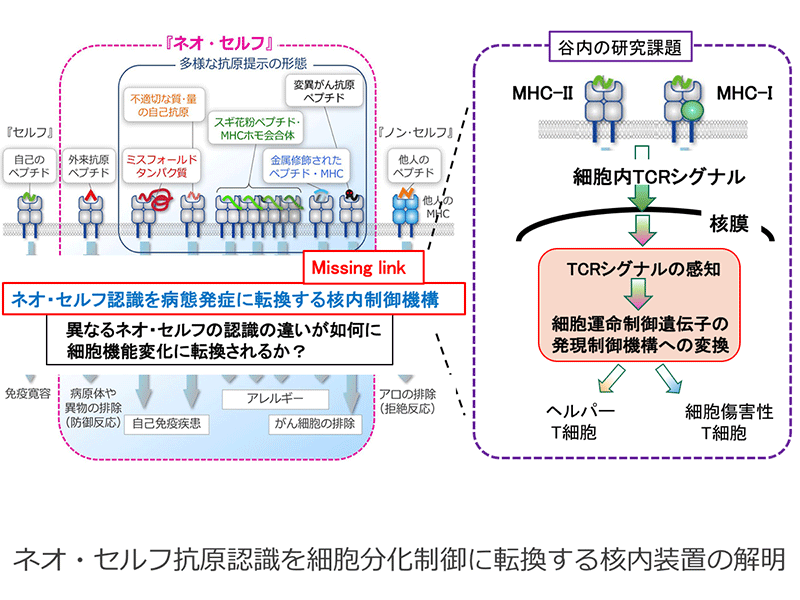
新たな抗原提示の形態による抗原認識(ネオ・セルフ)が関与する免疫応答のメカニズムを多角的な視点で解明することを目的とする本新学術領域において、T 細胞抗原受容体(TCR)によるネオ・セルフ抗原認識による質・量的に微細な変化が、どのようにして病的なT細胞分化に繋がるか理解することは重要である。
本研究では異なるMHCを介した抗原認識がヘルパー/キラーT細胞系列決定をTCR信号を細胞分化に転換する核内制御機構のモデルと捉え、T細胞系列決定遺伝子群の発現誘導に深く関与するBcl11b転写因子の機能解明、特にC末端のZinc-finger領域を介した制御機構に着目し、アナログ的なTCR信号の差異を感知すし、細胞分化制御に転換する核内装置の分子実体を明らかにすることを目的に研究を行う。またSite-specific ChIP 法を応用し特定のゲノム制御領域上の生体分子を同定する手法の開発し、例えばThpokサイレンサー上の分子複合体の同定を行う。
Nat Immunol.in press
Cell Report. 19(6):1176-1188, 2017. doi: 10.1016/j.celrep.2017.04.038.
Nat Immunol. 18(2):173-183, 2017. doi: 10.1038/ni.3646
自己認識によるT細胞活性化の制御
| 研究代表者 |  |
斉藤 隆 | 理化学研究所 統合生命医科学研究センター 免疫シグナル研究グループ グループディレクター 研究室HPへ(http://www.riken.jp/research/labs/ims/cell_signal/) |
斉藤班 研究概要
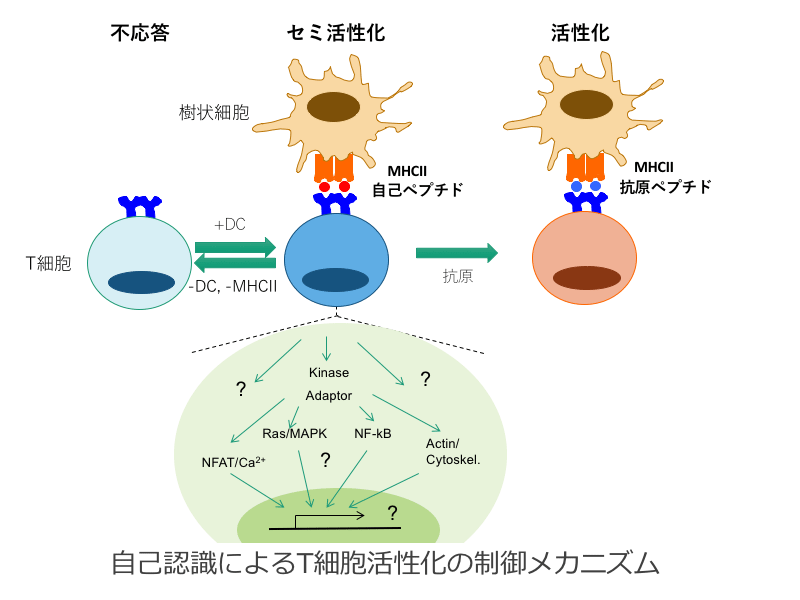
T 細胞は恒常的に樹状細胞と相互作用し、自己ペプチド/MHC を認識することによって、セミ活性化状態が誘導される。セミ活性化(Basal 活性化)が、抗原特異的活性化の惹起に必要である一方、Basal 活性化が無いとT 細胞は不応答状態に陥ることから、Basal 活性化は T 細胞活性化に極めて重要な制御であると考えられる。しかし、Basal 活性化は間接的に機能的に示唆されているだけであり、生体内でどの細胞と何処で相互作用し、どのような活性化シグナルを誘導し、活性化状態にあるのか、など多くは不明である。本研究では、T 細胞が恒常的 に樹状細胞などと相互作用して自己を認識して誘導されるBasal 活性化シグナルの実態と活性化状態の解析を行なう。また、生体内でのBasal 活性化を誘導する細胞を同定し、自己寛容の誘導とその解除の機構を解析する。
Nat Commun. 7:12756, 2016. doi:10.1038/ncomms12756.
J Exp Med. 213(8):1609-25, 2016. doi: 10.1084/jem.20151088.
J Exp Med. 213(1):123-38, 2016. doi: 10.1084/jem.20150519.
公募研究A02 ネオ・セルフの構造的理解
リン酸化プロテオミクスによるネオセルフを決定する胸腺T細胞シグナル伝達機構の解明
| 研究代表者 |  |
弓本 佳苗 | 九州大学 生体防御医学研究所 細胞機能制御学部門 特任助教 研究室HPへ(http://www.bioreg.kyushu-u.ac.jp/saibou/) |
| 連携研究者 | 中山 敬一 | 九州大学 生体防御医学研究所 細胞機能制御学部門 教授 |
弓本班 研究概要
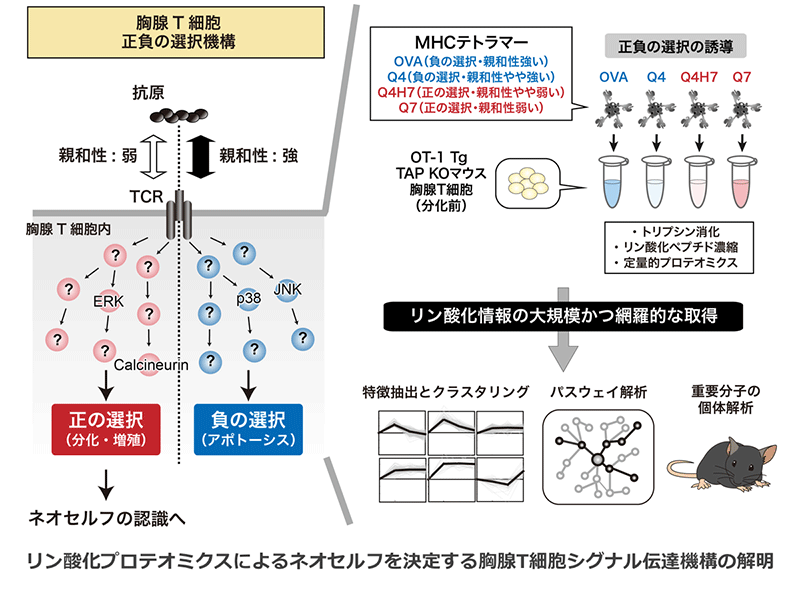
免疫機構の司令塔であるT細胞は、外来抗原だけではなく「自己(セルフ)」の異常から生じる腫瘍抗原や変異タンパク質などの「異常な自己(ネオセルフ)」を認識・排除することで体の恒常性維持を担う。こうしたT細胞の適切な識別能は、主として胸腺における「正負の選択」によって決定される。正負の選択では、抗原認識の際のT細胞とT細胞受容体(TCR)の親和性の違いにより、分化・増殖するか(正の選択)、死に至るか(負の選択)が決まる。しかし、抗原とTCR間の親和性の強弱がT細胞に生と死という正反対のアウトプットを引き起こす「強度特異的なシグナル伝達と運命決定機構」の全体像は不明である。
本研究では、我々が開発したPhospho-iTRAQ法を用い、正と負の抗原刺激によって起こる胸腺T細胞のリン酸化変化を大規模に捉え、正と負の抗原刺激に対する認識の違いが生死を決定するに至るまでに生じるシグナル伝達機構の全貌解明を目指す。
Genes Cells. 21(10):1095-1112, 2016. doi: 10.1111/gtc.12406.
J Clin Invest. 125(2):621-35, 2015. doi: 10.1172/JCI78782.
J Proteome Res. 11(6):3175-85, 2012. doi: 10.1021/pr201216u.
造血細胞移植に関わる新たなアロ免疫認識機構の解明
| 研究代表者 |  |
森島 聡子 | 琉球大学 大学院医学研究科 内分泌代謝・血液・膠原病内科学講座 准教授 研究室HPへ(http://www.ryudai2nai.com/) |
| 連携研究者 | 森島 泰雄 | 愛知医科大学 医学部 造血細胞移植振興寄附講座 客員教授 |
森島班 研究概要
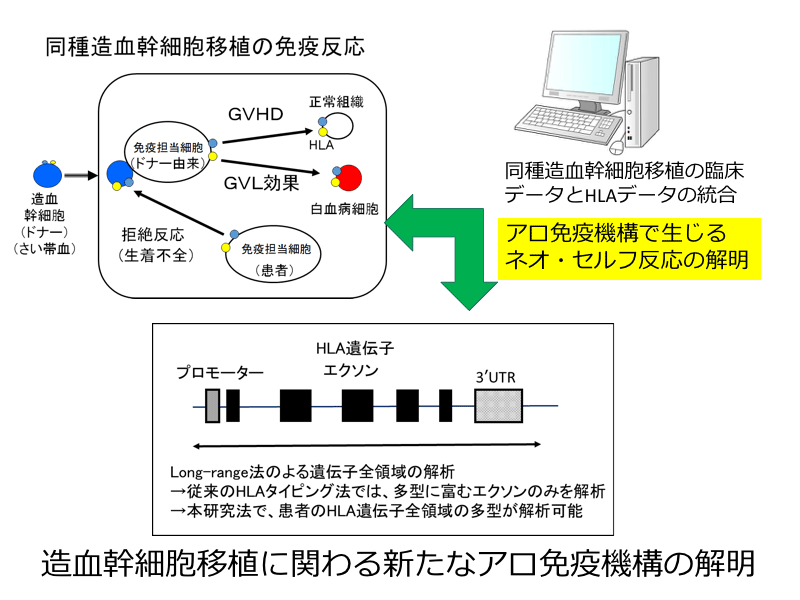
ヒト組織適合性抗原(HLA)はペプチドと結合して細胞表面上に提示され、T細胞受容体のリガンドとなって免疫応答を惹起するために必須の分子です。腫瘍免疫や自己免疫における「ネオ・セルフ生成」においても、重要な役割を果たしています。
同種造血幹細胞移植とは他者の造血幹細胞をいわば人工的に患者さんに移植する治療法です。移植後の移植片対宿主病(GVHD)や移植片対白血病効果(GVL効果)には患者とドナーのHLAの違いや患者自身のHLAの種類が影響します。ヒトのアロ免疫認識機構により生じるGVHDやGVL反応におけるHLA遺伝子領域の関与を詳細に解析することで、従来限られたエクソンの情報のみで決定されたHLAアリル情報に基づいて解析されてきたHLAと移植免疫反応の関連性を見直し、新たなアロ免疫機構を明らかにします。自己免疫疾患の機序とは異なった視点でネオ・セルフの認識機構を追及することを目指します。
Haematologica. 101(4):491-8, 2016. doi: 10.3324/haematol.2015.136903.
Blood. 125(7):1189-97, 2015. doi: 10.1182/blood-2014-10-604785.
Blood. 115(23):4664-70, 2010. doi: 10.1182/blood-2009-10-251157.
