平成31(令和元)年度~令和2年度 公募研究紹介
▼公募研究A01 ネオ・セルフの機能的理解 ▼公募研究A02 ネオ・セルフの構造的理解
公募研究A01 ネオ・セルフの機能的理解
iNKT細胞の胸腺内分化運命決定とネオ・セルフ抗原の役割
| 研究代表者 |  |
木村 元子 | 千葉大学 大学院医学研究院 免疫発生学・国際アレルギー粘膜免疫学 准教授 研究室HPへ (http://www.m.chiba-u.ac.jp/class/meneki/member/member_kimura.html) |
研究概要

iNKT細胞は、糖脂質抗原を認識するT細胞抗原受容体を有する細胞集団であり、感染症、抗腫瘍免疫、自己免疫疾患などに重要な働きをする。胸腺内で少なくとも機能の異なる3つのサブセット(NKT1、NKT2、NKT17細胞)へと分化することが知られているが、その分化機構、機能メカニズムは不明点が多い。またiNKT細胞は、遺伝背景の違いによって、そのサブセット分化が大きく影響を受けること(分化多様性)が知られているが、分化多様性を生む分子機構は不明である。さらに、iNKT細胞の一部は胸腺常在性となり、胸腺機能に影響を与えることが示唆されているが、その機能の実態は未だ不明点が多い。当研究では、iNKT細胞分化運命決定を担う‘ネオ・セルフ’としての糖脂質抗原の存在を念頭におき、その違いがもたらす結果のメカニズム解析を行う。そして、iNKT細胞の分化運命決定が胸腺でなされることの生体としての意義、生体の免疫応答に果たす役割を明らかにする。
Nat. Commun. 9(1):3749-60, 2018. doi: 10.1038/s41467-018-06283-1.
Nat. Immunol. 17(12):1415-23, 2016. doi: 10.1038/ni.3560.
Sci. Immunol. 1(3):eaaf9154-63, 2016. doi: 10.1126/sciimmunol.aaf9154
制御性T細胞による組織特異的自己免疫寛容誘導・維持機構の解明
| 研究代表者 |  |
堀 昌平 | 東京大学 大学院薬学系研究科 免疫・微生物学教室 教授 研究室HPへ(http://www.f.u-tokyo.ac.jp/~bisei/) |
研究概要
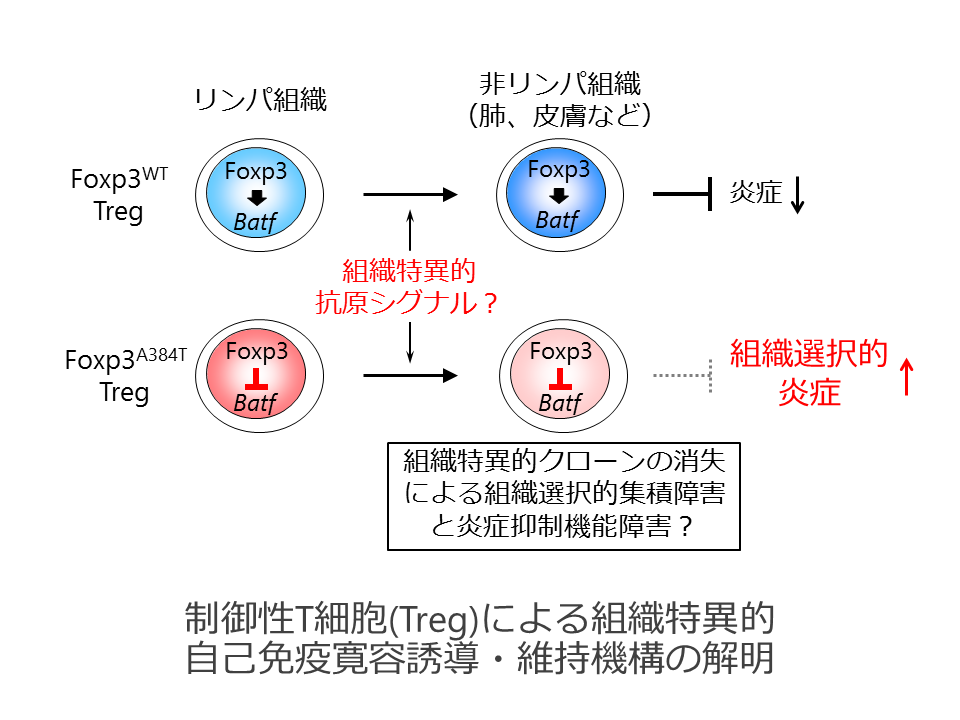
制御性T細胞(Treg)は免疫応答を負に制御することで自己免疫、炎症、アレルギーなど様々な病的免疫応答を抑制し、自己免疫寛容に必須の役割を担っています。Tregの分化と抑制機能には、転写因子Foxp3に加えてTCRを介した抗原認識も重要です。我々は、ヒト自己免疫疾患IPEXにおいて同定されているFoxp3変異を導入したマウスモデルを作製・解析し、Tregが活性化して皮膚や肺などの特定の組織へ集積する過程を障害することで組織選択的な自己免疫疾患を惹起するFoxp3A384T変異を同定しました。本研究では、「Foxp3とTCRシグナルが機能的に協調することで”セルフ”や”ネオ・セルフ”抗原が発現する組織に選択的に集積し、組織特異的に免疫寛容を成立させている」という仮説を立て、Foxp3A384T変異マウスをモデルとしてこの仮説の検証を行います。
Immunity, 36(2):262-75, 2012. doi: 10.1016/j.immuni.2011.12.012.
Immunol Rev., 259(1):159-72, 2014. doi: 10.1111/imr.12175.
Immunity, 47(2):268-83.e9, 2017. doi: 10.1016/j.immuni.2017.07.008.
T細胞レパトア選択における胸腺ネオ・セルフ抗原の意義
| 研究代表者 |  |
新田 剛 | 東京大学 大学院医学系研究科 免疫学 准教授 研究室HPへ(http://osteoimmunology.com/) |
研究概要
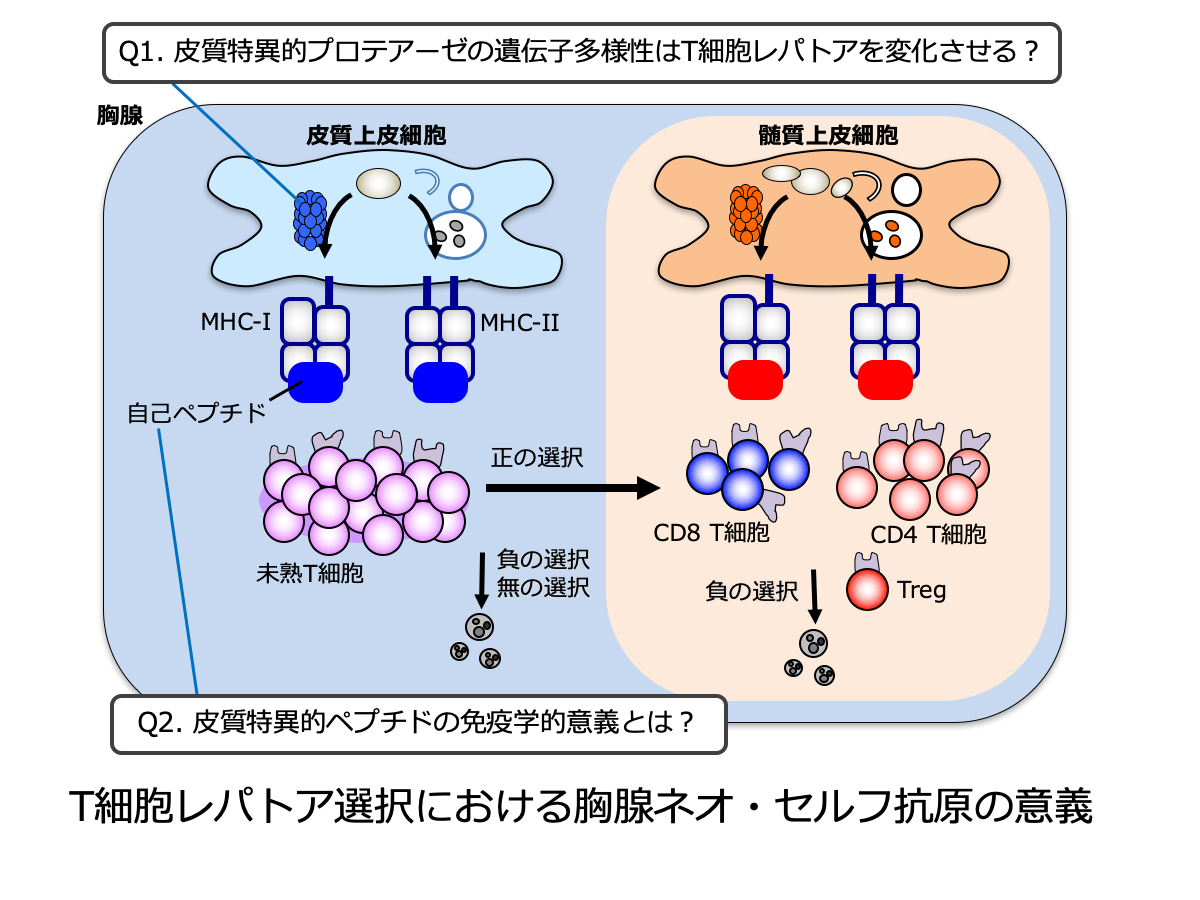
T細胞の抗原認識レパトアは、胸腺内に提示された自己ペプチドの認識にもとづく正/負の選択を通して形成されます。胸腺の皮質では、固有のプロテアーゼ(胸腺プロテアソームやリソソームプロテアーゼ)が発現し、正の選択に重要なユニークな(「非自己」の性質を有する)ペプチドが作られます。これらのプロテアーゼの遺伝子には、変異や多型が高頻度に存在します。私たちはこれまでの研究で、胸腺プロテアソーム因子PSMB11の多型が、胸腺内のMHCクラスI抗原ペプチドを変化させ、CD8 T細胞レパトアを変容させることを明らかにしました。現在、リソソームプロテアーゼPRSS16の多型についても、CD4 T細胞や制御性T細胞のレパトア選択への影響を中心に解析を進めています。また、なぜ胸腺の皮質には「非自己」抗原ペプチドが生成される必要があるのかを明らかにし、T細胞の抗原認識レパトアを生み出す原理の解明に挑戦します。
J Clin Invest., 128(1):415-26,2018. doi: 10.1172/JCI95837
Sci Immunol., 2(12):eaan5165, 2017. doi: 10.1126/sciimmunol.aan5165
Immunity, 32(1): 29-40, 2010. doi: 10.1016/j.immuni.2009
核抗原への自己抗体産生における変性自己抗原の役割の解明
| 研究代表者 |  |
鍔田 武志 | 東京医科歯科大学 難治疾患研究所 免疫疾患分野 教授 研究室HPへ(http://www.tmd.ac.jp/mri/section/pathophysiology/imm/) |
研究概要
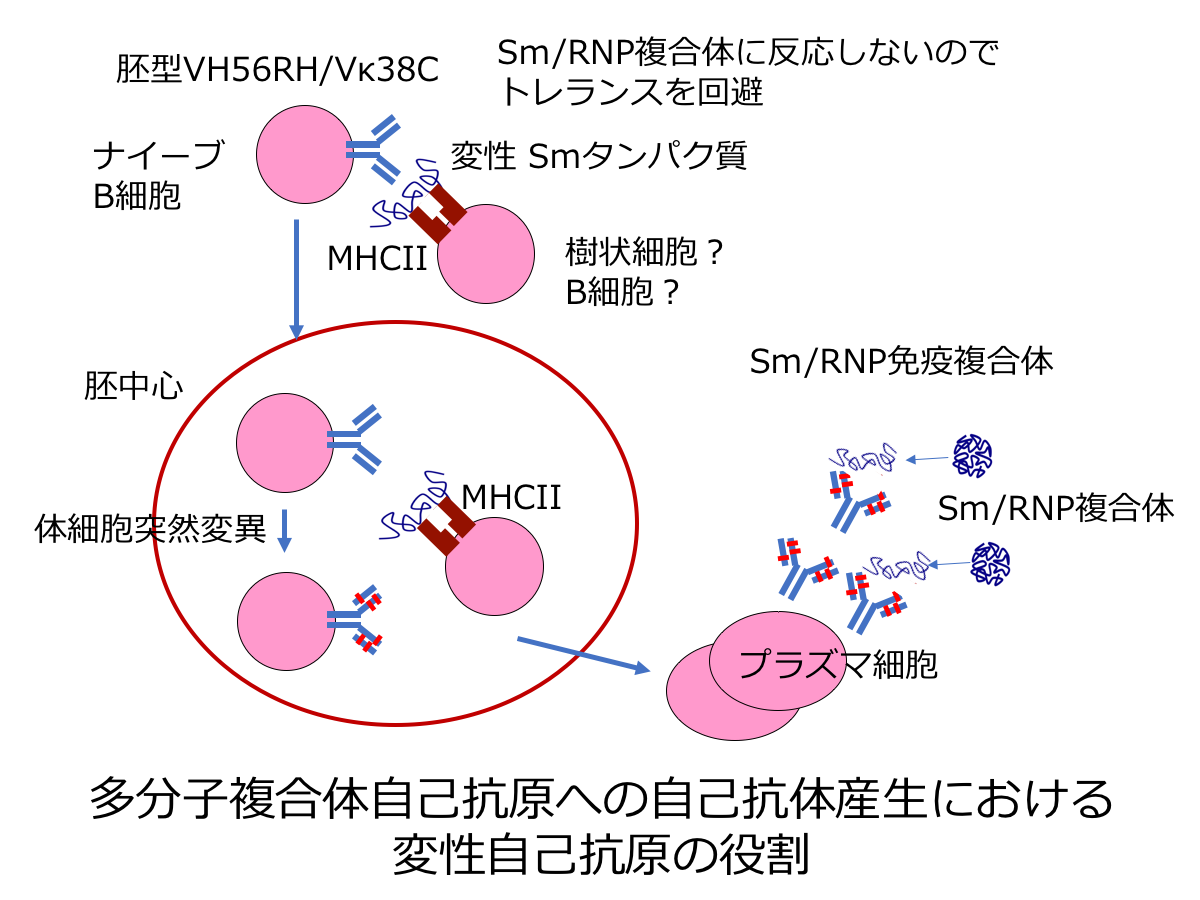
全身性エリテマトーデス(SLE)などのリウマチ性自己免疫疾患では種々の多分子複合体への自己抗体産生がおこる。多分子複合体の構成成分が分離するなどの変化により新たなエピトープが露出しネオセルフとして機能する可能性が考えられる。我々はこれまでに、SLEで自己抗体の標的となる多分子複合体Sm/RNPへの胚型自己抗体がもっぱら変性Sm/RNPに反応すること、さらに、エンドサイトーシスにより取り込まれた変性Smタンパク質がMHCIIによって提示されることを明らかにした。本研究では、変性Smタンパク質のネオセルフとしての役割とMHCIIによる変性Smタンパク質提示の役割を解明することで、リウマチ性疾患での多分子複合体への自己抗体産生メカニズムを解明する。
【参考論文】
J Exp Med., 213(12):2691-2706, 2016. doi: 10.1084/jem.20160560
J Immunol., 190(7):3189-96, 2013. doi: 10.4049/jimmunol.1203364
Proc Natl Acad Sci USA., 109(20):7811-16, 2012. doi: 10.1073/pnas.1204509109
「リポペプチド」抗原提示機構の解明~分子構造、細胞機能そして個体へ~
| 研究代表者 |  |
杉田 昌彦 | 京都大学 ウイルス・再生医科学研究所 細胞制御研究分野 教授 研究室HPへ(http://www.infront.kyoto-u.ac.jp/ex_ivr/Lab/SugitaLab.html) |
研究概要
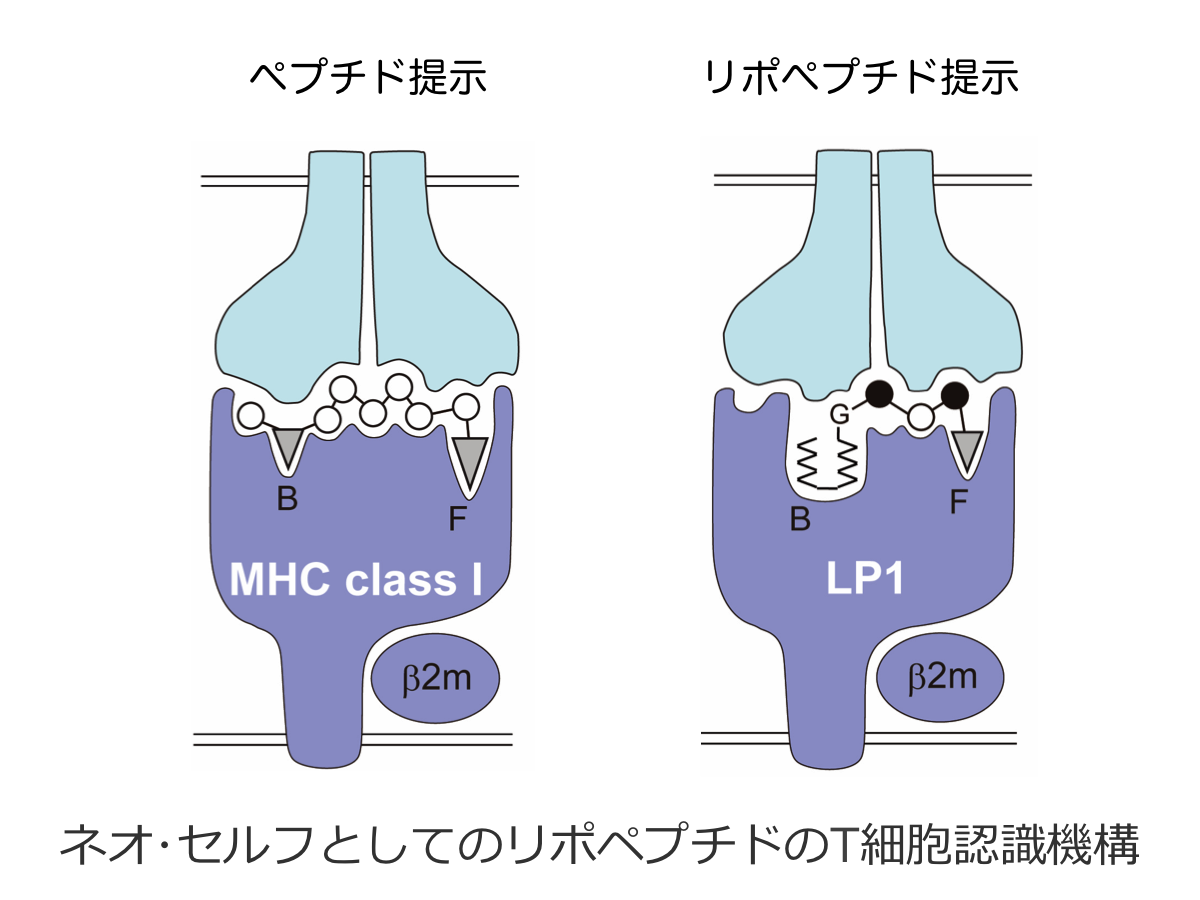
本研究は研究代表者が世界に先駆けて発見し2016年に発表した「MHCクラス1分子によるリポペプチド抗原提示」の研究を深化させ、MHCの新たな研究領域の構築を目指すものである。アカゲザルエイズモデルを活用した研究代表者のこれまでの研究から、一部のアカゲザルMHCクラス1アリル(LP1と総称する)が、ミリスチル化ウイルスタンパク質に由来するリポペプチドを結合しT細胞に提示することが示され、リポペプチドリガンドを結合した複合体のX線結晶構造が解明された。本研究では、ネオセルフとしてのリポペプチドを提示するMHCクラス1経路のさらなる全容解明に向け、LP1の発現変異細胞株及び機能変異細胞株を樹立し、LP1の発現と機能を制御する分子群を同定する。さらに、遺伝子改変技術を用いてリポペプチド免疫系を再構築したマウス個体を作出し、個体レベルでの解析基盤を確立する。
J Immunol., 2019 (in press).
Nat Commun., 7:10356, 2016. doi: 10.1038/ncomms10356.
スプライシング因子変異細胞のネオ・セルフとがん免疫療法
| 研究代表者 |  |
依田 成玄 | 京都大学大学院 医学研究科 腫瘍生物学講座 特定准教授 研究室HPへ(http://plaza.umin.ac.jp/kyoto_tumorpatho/) |
研究概要
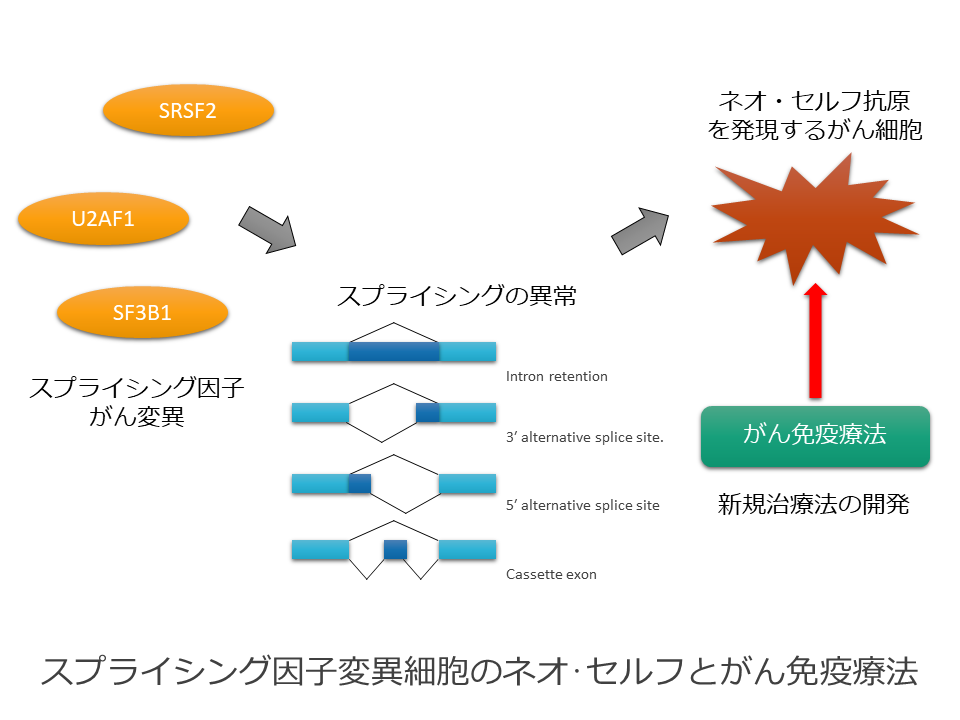
骨髄異形成症候群、慢性リンパ性白血病、急性骨髄性白血病、ぶどう膜悪性黒色腫、肺がん、腎細胞がんなど、様々な悪性腫瘍において、SF3B1、SRSF2、U2AF1などのスプライシング因子に高頻度の体細胞変異が報告されています。スプライシング因子がん変異を直接標的とした抗がん薬は開発されておらず、スプライシング因子がん変異を有する腫瘍の新規治療法の開発が期待されています。
スプライシング因子変異により異常なスプライシング産物(異常なスプライシングバリアント)が産生されることが報告されていますが、これより合成される異常タンパク質(ネオ・セルフ)をターゲットとしたがん免疫治療が可能であると考えられます。本研究では、ネオ・セルフ抗原の増加が予想されるスプライシング因子変異がんに対して、抗PD-1抗体を用いたがん免疫治療が効果があるかどうか検討します。
Leukemia.; 33(3):612-624, 2019. doi: 10.1038/s41375-018-0253-3.
Nat Med.; 21(1):71-5, 2015 doi: 10.1038/nm.3751.
Blood.; 120(14):2853-63, 2012 doi: 10.1182/blood-2012-02-413252.
ヒト免疫細胞と再生組織を用いた自己免疫疾患モデルの樹立
| 研究代表者 |  |
河本 宏 | 京都大学 ウイルス・再生医科学研究所 再生免疫学分野 教授 研究室HPへ(http://kawamoto.frontier.kyoto-u.ac.jp/) |
研究概要
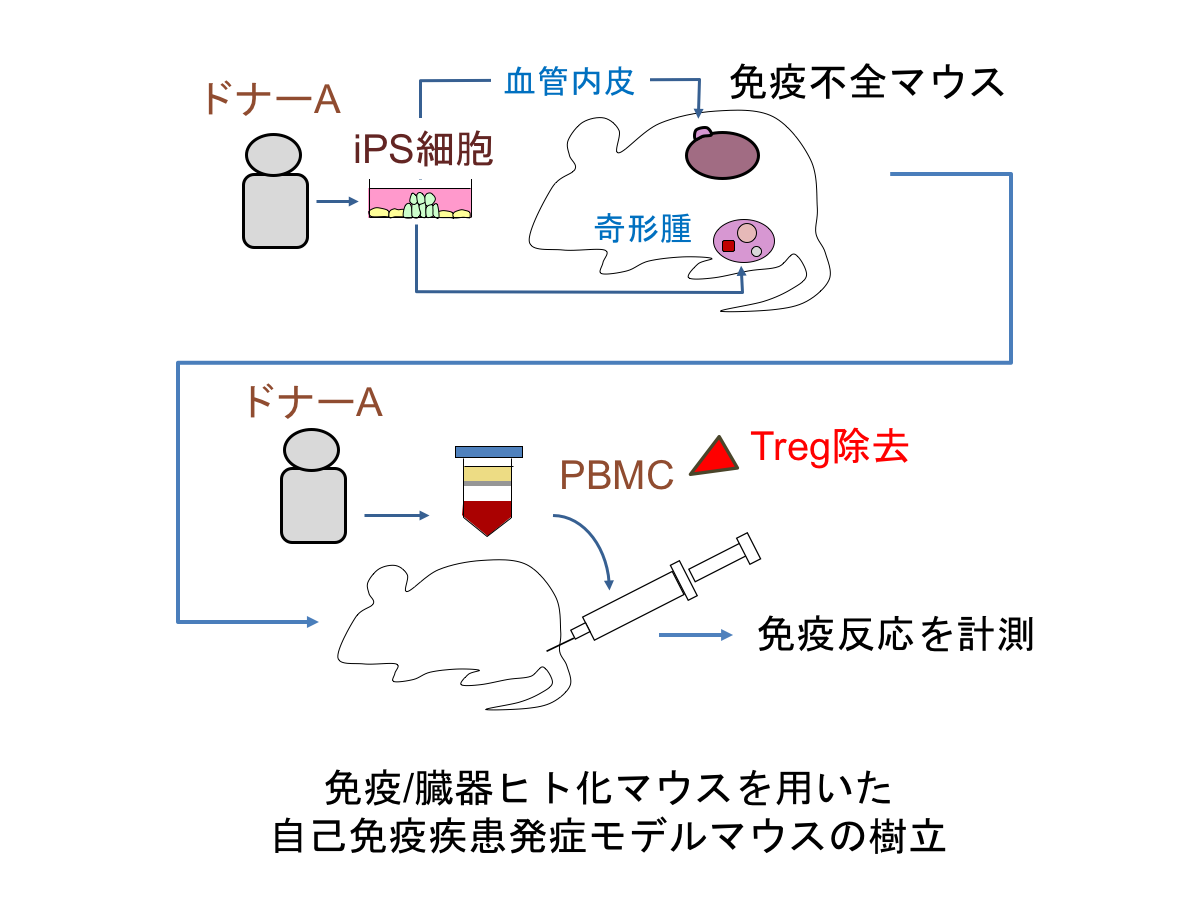
本申請研究は、ヒトの自己免疫疾患発症モデルの樹立を目指す。マウスの自己免疫疾患モデルは多数存在するが、ヒトの自己免疫疾患モデルは、現時点では存在しません。もしもヒト細胞を用いた生理的な自己免疫疾患発症モデルがあれば、病原性クローンの詳細な動態やエピトープスプレッディングの過程の解明、治療法の開発などに役立つと期待できると考えました。本研究では、特定の健常人ドナーからの末梢血単核球と、同ドナー由来のiPS細胞から再生した各種組織を、免疫不全マウスに構築するという、新規な動物モデルを樹立することを目指します。ここでは仮に「免疫/臓器ヒト化マウス」と呼びます。このマウスを用いて、まずアロの系で免疫反応が検出できるか検証します。次に自己の系で免疫反応が惹起できるか検証します。自己免疫疾患の誘発には、制御性T細胞の除去などを行う予定です。
Stem Cell reports, 9(3):853-67, 2017.doi: 10.1016/j.stemcr.2017.07.020.
Cancer Research, 76(23):6839-50, 2016. doi: 10.1158/0008-5472.CAN-16-1149.
Cell Stem Cell, 12(1): 31-6. 2013. 10.1016/j.stem.2012.12.006.
ネオセルフ 化ペプチドによる新規免疫制御機構の解明
| 研究代表者 |  |
荒瀬 尚 | 大阪大学 微生物病研究所 免疫化学分野 教授 研究室HPへ(http://immchem.biken.osaka-u.ac.jp/) |
研究概要
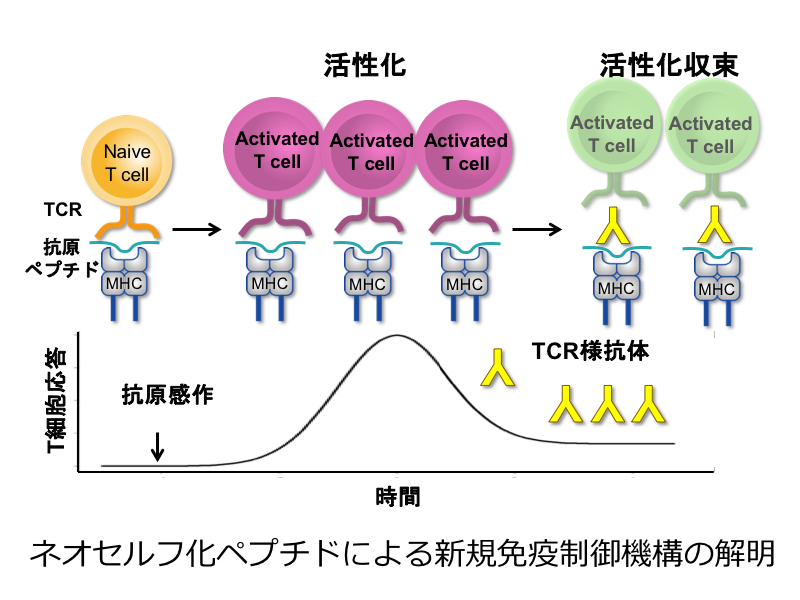
我々はMHCクラスII分子に提示されたミスフォールド蛋白質が自己抗体の標的となっていることを明らかにしてきた。さらに、特定の抗原に対する免疫応答では、ペプチド/MHCクラスII分子複合体に対する抗体が産生され、T細胞の抗原認識を阻害し、T細胞応答を抗原特異的に抑制することが明らかになってきた。また、ペプチド/MHCクラスII分子複合体に対する抗体が産生には、ペプチドのC末やN末の配列が重要であることが判明した。そこで、本研究では、ペプチド/MHCクラスII分子複合体に対する抗体を誘導することによって、自己免疫疾患やアレルギー疾患における免疫応答を抗原特異的に抑制できるかを解析する。本研究により様々な免疫応答を抗原特異的に制御することが出来るようになる可能性が期待される。
Nature., 552(7683):101-05, 2017. doi: 10.1038/nature24994.
Arthritis Rheumatol., 69(10):2069-80, 2017. doi: 10.1002/art.40170.
Proc Natl Acad Sci USA., 111(10):3787-92, 2014. doi: 10.1073/pnas.1401105111.
細胞内膜ネオセルフ・ネオノンセルフ維持機構とその破綻による疾患発症機序の解明
| 研究代表者 |  |
山本 雅裕 | 大阪大学 微生物病研究所 感染病態分野 教授 研究室HPへ(http://immpara.biken.osaka-u.ac.jp/) |
研究概要
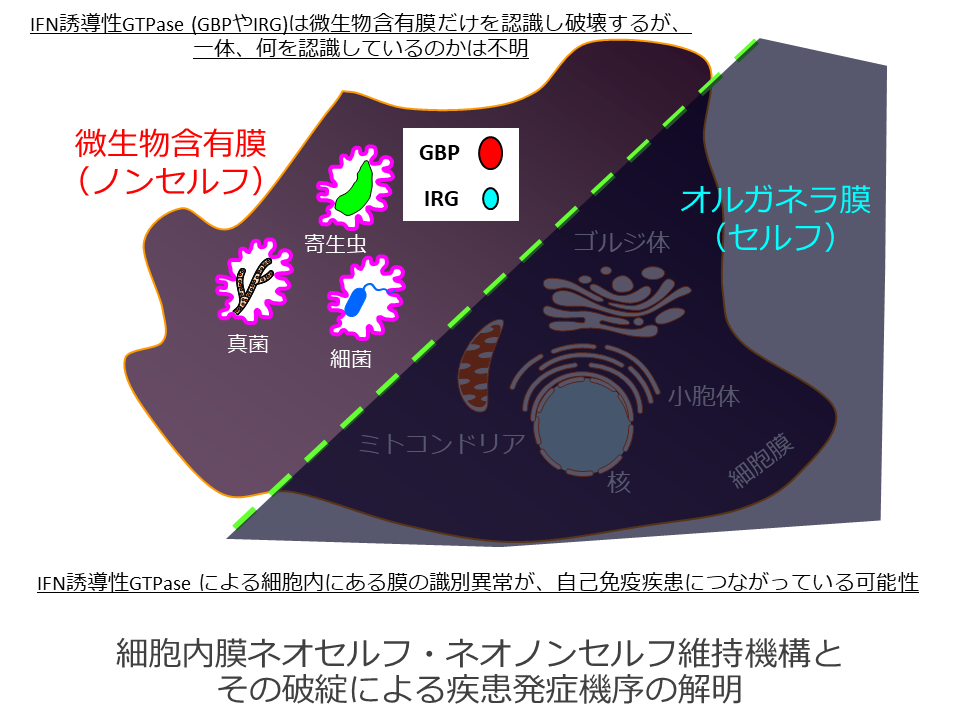
感染細胞内に形成され微生物含有小胞(MCV)の膜に蓄積し破壊するIFN誘導性GTPaseが何を認識している物質は不明である。MCV膜は本来宿主細胞膜に由来し、さらに対象が原核生物から真核生物由来と幅広いことから、IFN誘導性GTPaseは微生物由来物質ではなく、MCV膜上の宿主(自己)由来の未知の物質(ネオセルフ)を非自己として認識している可能性がある。またヒトのIFN誘導性GTPaseホモログであるIRGMの変異が炎症性腸疾患の原因であることから、IFN誘導性GTPaseによる細胞内の膜のネオセルフ・ネオノンセルフ識別異常・不全により起きている可能性がある。そこで本研究では、IFN誘導性GTPaseの認識するネオセルフ物質の同定によって『細胞内“膜”のネオセルフ・ネオノンセルフ』という新概念を提唱し、さらにその破綻による炎症性腸疾患の新規発症メカニズムを明らかにすることを目的とする。
Nat Immunol., 2017 Aug;18(8):899-910. doi: 10.1038/ni.3767.
Proc Natl Acad Sci USA., 2015 Aug 18;112(33):E4581-90. doi: 10.1073/pnas.1510031112.
J Immunol., 2014 Apr 1;192(7):3328-35. doi: 10.4049/jimmunol.1302822.
ネオセルフを標的としたCAR T細胞療法の開発
| 研究代表者 |  |
保仙 直毅 | 大阪大学大学院 医学系研究科 癌幹細胞制御学 准教授 |
研究概要
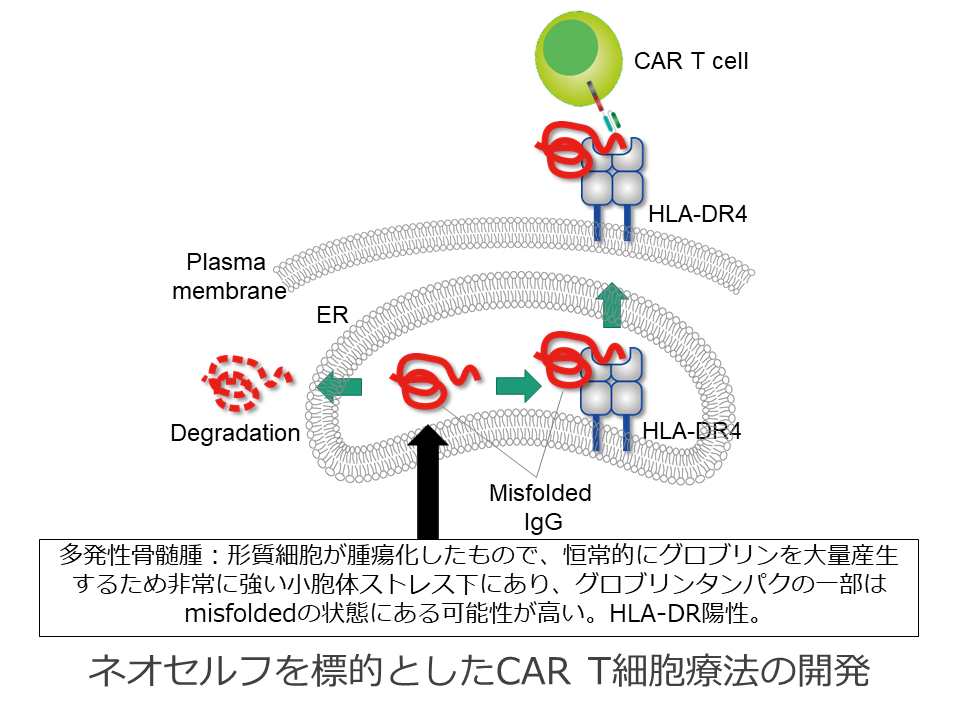
最近我々は、多発性骨髄腫においてインテグリンb7が恒常的に活性化していることを見出し、その活性型構造を特異的に認識する抗体を元に作製したCAR T細胞が強い骨髄腫特異的細胞傷害活性を有することを示した。このことは、変異のないタンパクの特定の立体構造を標的としたがん特異的CAR T細胞療法が可能であることを示している。そのような標的抗原の候補として考えられるのが、大阪大学の荒瀬らが近年報告したClass II HLAに結合し細胞表面に提示されるmisfoldedタンパクである。多発性骨髄腫細胞はClass II HLAを発現しており、常に大量のIgGを産生するため非常に高度な小胞体ストレスにさらされている。そこで、本研究では多発性骨髄腫において、Class II HLA/misfolded タンパク複合体という“ネオセルフ”を標的にしたCAR T細胞療法が可能かどうかを検討する。
Nat Med., 23(12):1436-1443,b 2017, Hosen, N. et al. The activated conformation of integrin beta7 is a novel multiple myeloma-specific target for CAR T cell therapy. doi:10.1038/nm.4431 (2017).
紫外線により誘導されるネオ・セルフ特異的制御性T細胞の新しい機能と治療戦略
| 研究代表者 |  |
山崎 小百合 | 名古屋市立大学 大学院医学研究科 免疫学 教授 研究室HPへ(http://www.med.nagoya-cu.ac.jp/immunol.dir/) |
| 連携研究者 | 森田 明理 | 名古屋市立大学大学院医学研究科 加齢環境皮膚科学 教授 |
研究概要
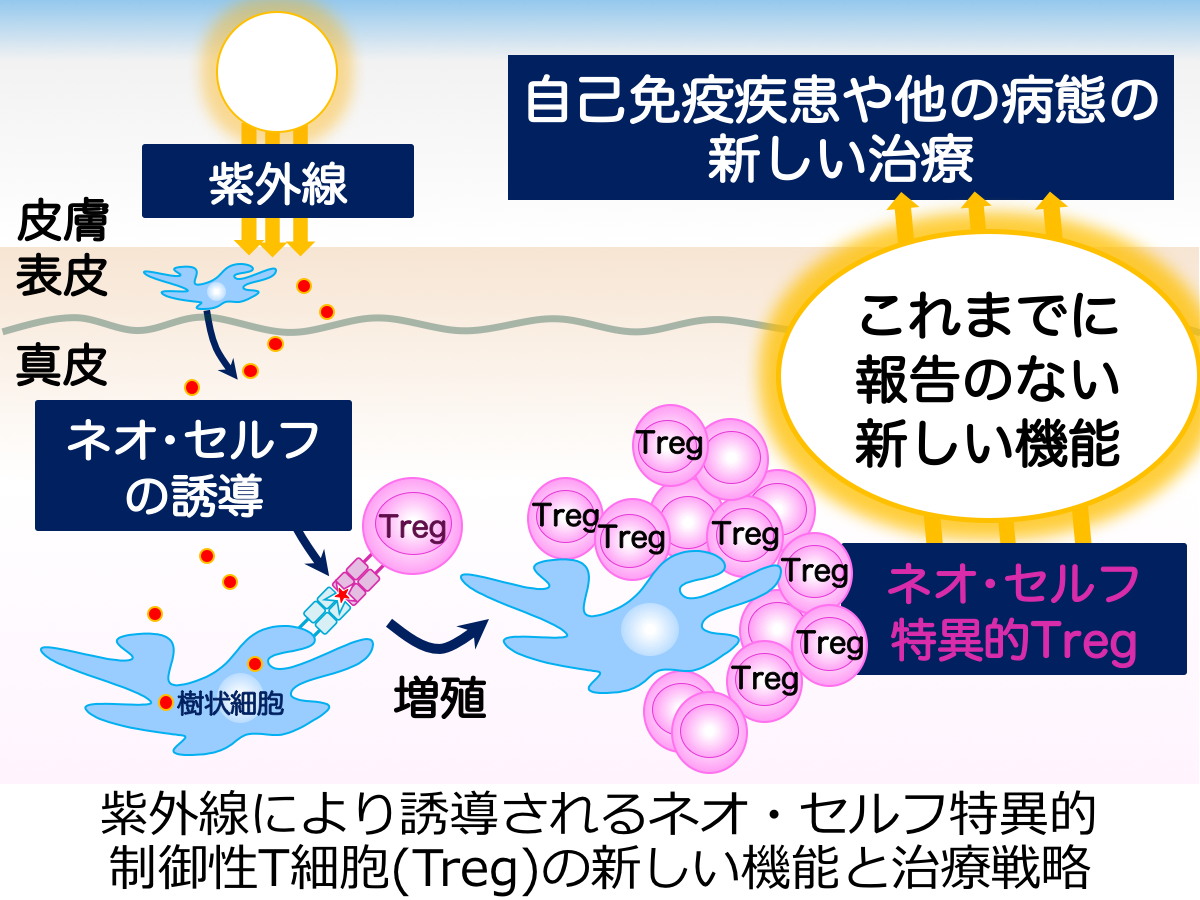
制御性T細胞は、ヒトやマウスの末梢CD4+T細胞の5-10%を占め、自己免疫疾患の発症やその他の重要な免疫反応を抑制しています。紫外線には免疫抑制効果があることが知られていますが、私たちは紫外線照射により制御性T細胞が皮膚のCD4+T細胞の約60%にも増えることを見出しました。この2年間の公募研究採択期間で、紫外線で誘導されるネオ・セルフを提示して制御性T細胞を増やしている皮膚の樹状細胞サブセットを同定することができました。本研究ではこれまでの研究成果をさらに発展させ、紫外線で誘導されたネオ・セルフ特異的制御性T細胞の新しい機能の解明を行い、新規治療戦略への貢献を目指します。
J Immunol., 200(1):119-29, 2018. doi: 10.4049/jimmunol.1701056.
Int J Cancer, 144(11): 2811-22, 2019. doi: 10.1002/ijc.32024.
J Invest Dermatol., 139(6):1329-1338, 2019. doi: 10.1016/j.jid.2019.01.029.
ネオ・セルフ生成における免疫プロテアソームの機能的および病理的意義の解明
| 研究代表者 |  |
改正 恒康 | 和歌山県立医科大学 先端医学研究所 生体調節機構研究部 教授 研究室HPへ(http://www.wakayama-med.ac.jp/med/seitai/) |
研究概要
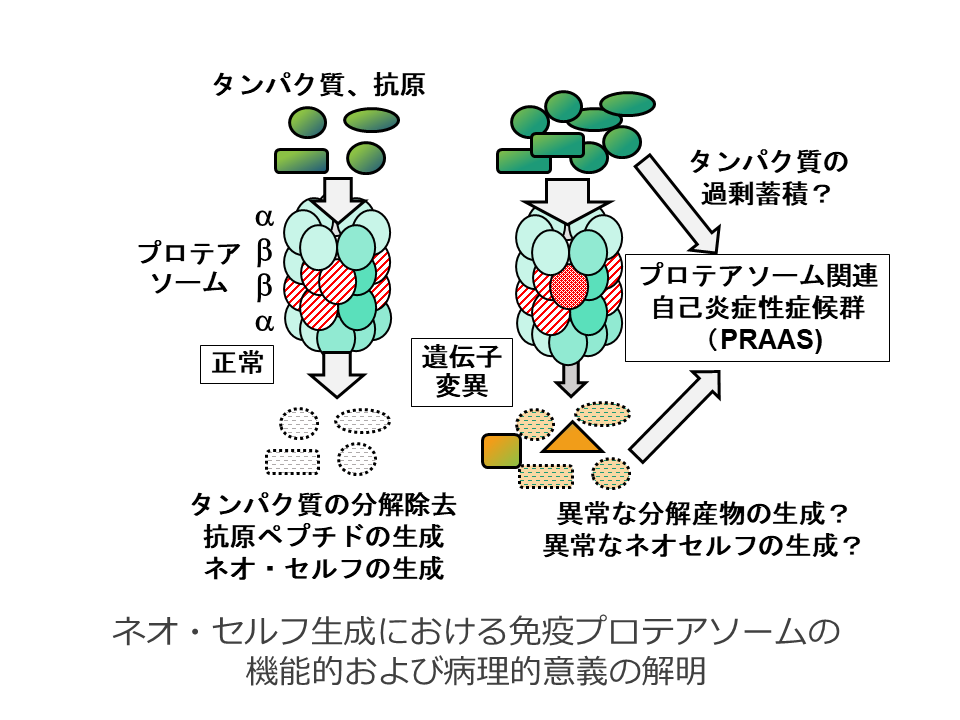
免疫プロテアソームは、複数のサブユニットから成るタンパク複合体であり、不要または不良のタンパクの分解除去ばかりでなく、MHCクラスIと会合する抗原の生成にも関与する。免疫プロテアソームのサブユニットの変異により、proteasome-associated autoinflammatory syndrome (PRAAS)と総称される難治性の炎症性疾患が生じるが、従来の免疫プロテアソーム機能についての考え方では、免疫プロテアソーム異常と病態との関連は説明できない。我々は、PRAAS様の患者に認められた、免疫プロテアソームサブユニットのアミノ酸置換を来す、新規の遺伝子変異をマウスに導入することにより、その変異が多彩な免疫異常を引き起こすことを見出した。本研究では、このユニークなマウスの解析を通じて、免疫プロテアソームの新たな機能的意義、病理的意義をネオ・セルフ生成機構の観点から解明する。
Int Immunol., early online, 2019. doi: 10.1093/intimm/dxz004.
Sci Rep. 6: 23505, 2016. doi: 10.1038/srep23505.
J Immunol. 190(12): 6071-82, 2013. doi: 10.4049/jimmunol.1202798.
ネオ・セルフ脂質抗原分子ライブラリ構築と免疫調節機能解析
| 研究代表者 |  |
藤本 ゆかり | 慶應義塾大学 理工学部 化学科 教授 研究室HPへ(http://www.chem.keio.ac.jp/~fujimoto-lab/) |
| 連携研究者 | 松丸 尊紀 | 慶應義塾大学 理工学部 化学科 助教 |
研究概要
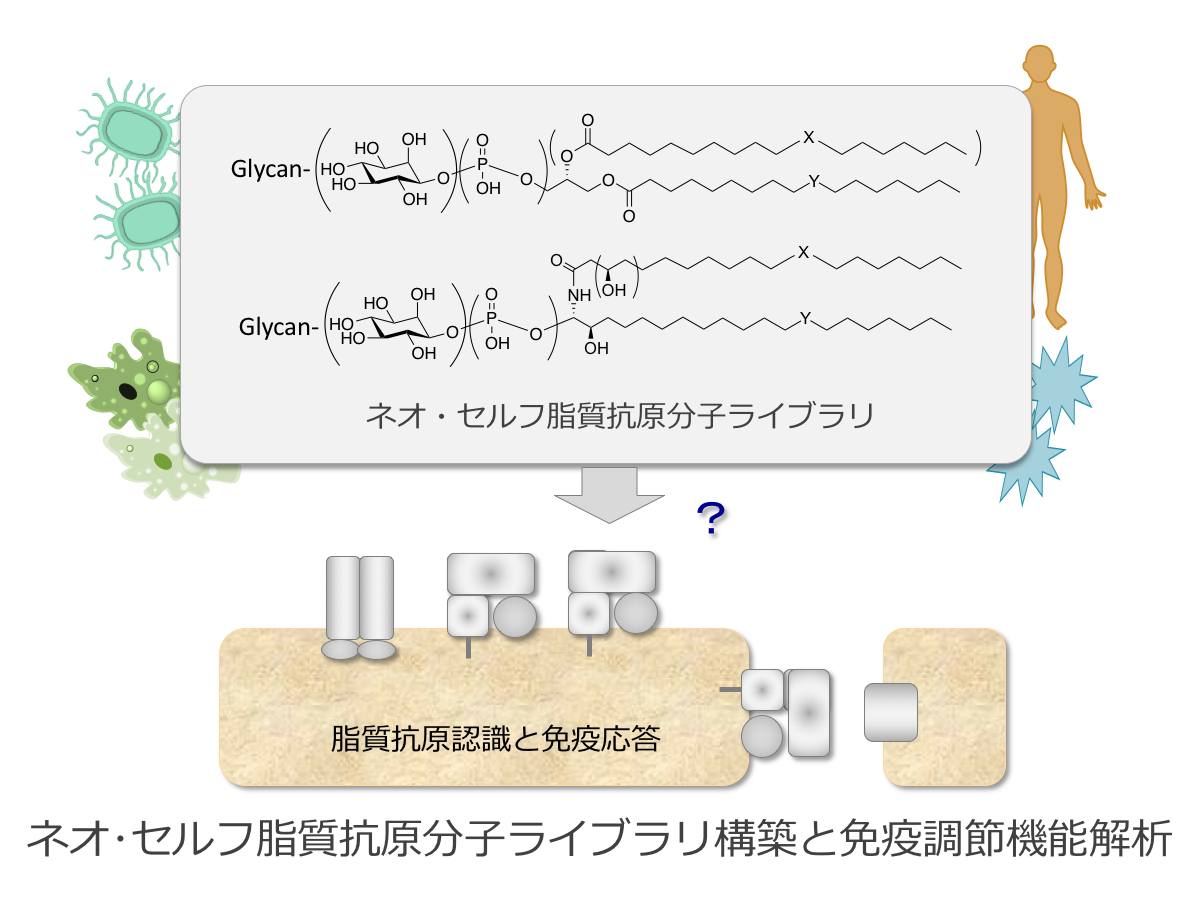
本研究においては、“ネオ・セルフ“抗原として、免疫活性化機構におけるサイトカイン・バランスの調節に非常に重要な役割を果たしている脂質抗原に着目し、まず天然型構造を中心とした“ネオ・セルフ“複合脂質分子ライブラリ構築を行う。脂質抗原分子ライブラリ構築においては、特に、非古典的MHC-1分子である脂質抗原受容体CD1、中でもCD1dによって認識される脂質構造に着目して合成研究を進める。一方、化学合成的に確立した脂質抗原分子ライブラリを用い、CD1d-脂質抗原複合体によるNKT細胞活性化の解析およびその免疫調節機構の解明を行う。解析に際しては、合成化合物を用いるメリットを生かした分子レベルおよび細胞における挙動解析等も含めた機能評価を行い、”ネオ・セルフ”脂質抗原の機能解析を目指す。
Angew Chem Int Ed., 57(31),9655-9659, 2018. doi: 10.1002/anie.201802983
Chem Eur J., 23(34), 8304-8, 2017. doi: 10.1002/chem.201701298
ACS Chem Biol., 11(11):3132-39, 2016. doi: 10.1021/6b00674
クロマチン抑制因子の破綻によるネオセルフ生成
| 研究代表者 |  |
竹馬 俊介 | 慶應義塾大学 医学部 微生物学・免疫学 講師 研究室HPへ(http://www.maroon.dti.ne.jp/schikuma/) |
研究概要
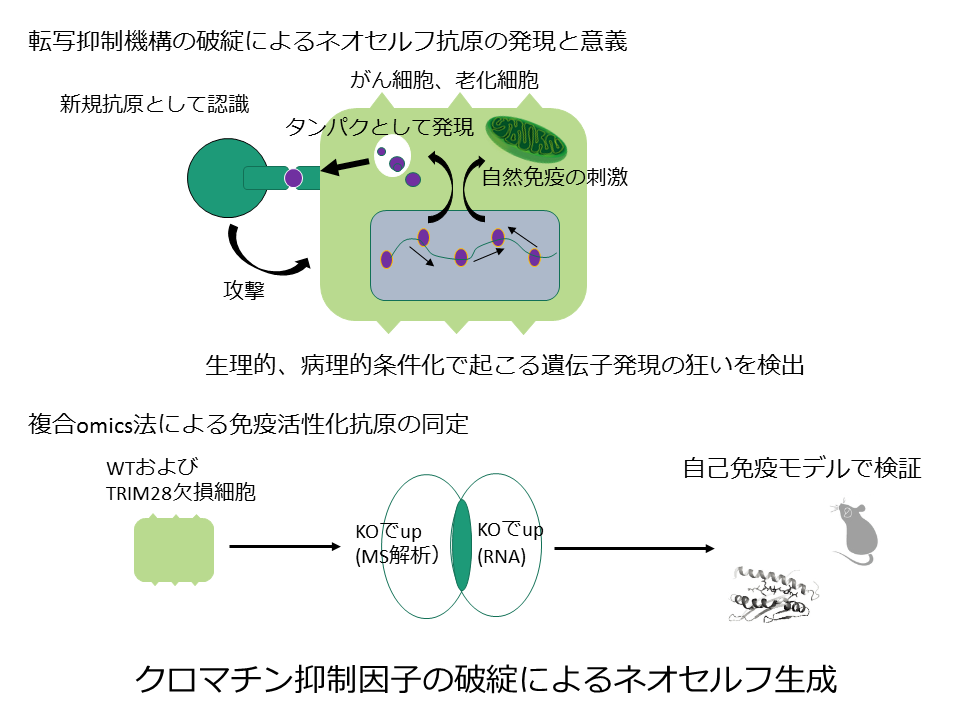
PD-1抗体をはじめとする免疫チェックポイント阻害剤ががんに有効であることが臨床で証明され、免疫系によるがん攻撃機構が治療にも有用であることが明らかとなりました。がんでは、遺伝子の変異や遺伝子発現調節機構に多くの狂いが生じ、非自己として認識される新規抗原を表出し、この抗原認識が起こりやすいほど免疫のターゲットとなりやすいことが示されています。一方、老化細胞におけるネオセルフ発現は、免疫系が自己を非自己と認識して攻撃するきっかけともなります。前研究期間に、クロマチン結合タンパクであるTRIM28の阻害により免疫刺激性のさまざまな抗原が脱抑制され獲得免疫のターゲットとなることを見出しました。これを発展させ、疾患モデル動物およびバイオインフォマティクスを駆使して疾患に密接に関わる「新規抗原」の本態と、その発現機構を明らかにし、がんおよび免疫関連疾患との関連を探求します。
Int J Clin Oncol, 21(3):448-55, 2016. doi: 10.1007/s10147-016-0958-0.
Nat Immunol., 14(12):1212-18, 2013. doi: 10.1038/ni.2762.
Nat Immunol., 13(6):596-603, 2012. doi: 10.1038/ni.2293.
脳内炎症における制御性T細胞のネオセルフ認識
| 研究代表者 |  |
伊藤 美菜子 | 慶應義塾大学 医学部 微生物学・免疫学 講師 研究室HPへ(http://new2.immunoreg.jp/) |
研究概要
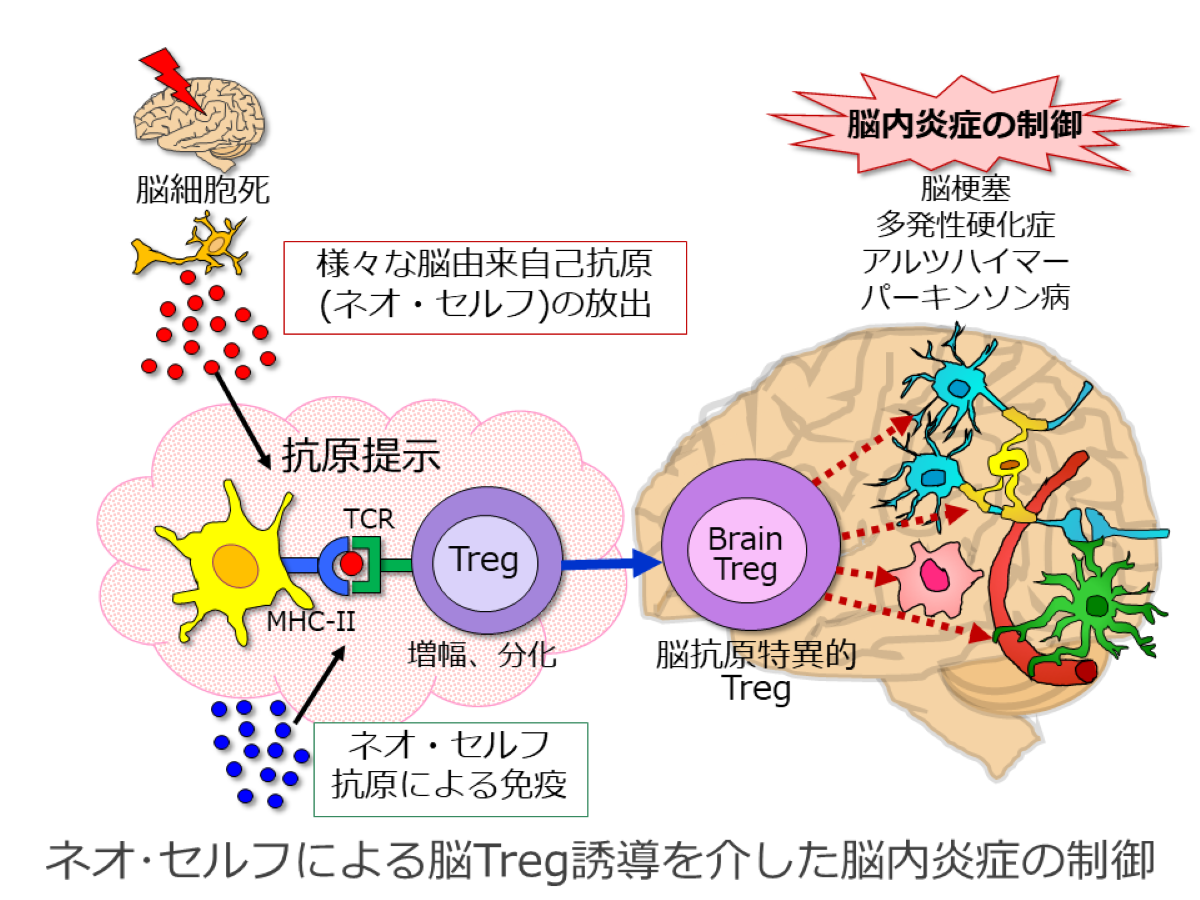
様々な中枢神経系関連疾患では自己免疫寛容の破綻が関与しています。多発性硬化症や抗NMDA受容体抗体脳炎などはもちろんのこと、パーキンソン病やアルツハイマーなどの神経疾患と慢性炎症やHLAなどの免疫系の関連性が報告されています。また、自閉症や統合失調症と、HLAによる疾患感受性との関連も強く示唆されています。中枢神経系における自己免疫を制御する機構、すなわち制御性T細胞による抑制機構・自己免疫寛容の解明は、様々な中枢神経系疾患の治療・予防法の開発においても重要な課題です。本研究では、脳Tregを誘導する脳由来自己抗原を同定し、脳抗原特異的な脳Tregを増殖させることによって、様々な中枢神経系疾患の制御機構や自己免疫寛容の確立機構を明らかにします。脳梗塞、EAE、アルツハイマー、パーキンソン病など様々な中枢神経系モデルを利用します。複数の脳Treg誘導抗原を同定し、中枢神経疾患の治療・予防に効果的なワクチン開発を目指します。
Nature., Jan;565(7738):246-50. 2019. doi: 10.1038/s41586-018-0824-5.
Nat Commun., Jun 10;6:7360. 2015. doi: 10.1038/ncomms8360.
腫瘍浸潤B細胞がT細胞に提示するがんネオセルフ抗原の同定
| 研究代表者 |  |
北村 大介 | 東京理科大学 生命医科学研究所 分子生物学研究部門 教授 研究室HPへ(https://dai3kitamura.jimdofree.com/) |
| 連携研究者 | 中面 哲也 | 国立研究開発法人 国立がん研究センター 先端医療開発センター 免疫療法開発分野長 |
研究概要
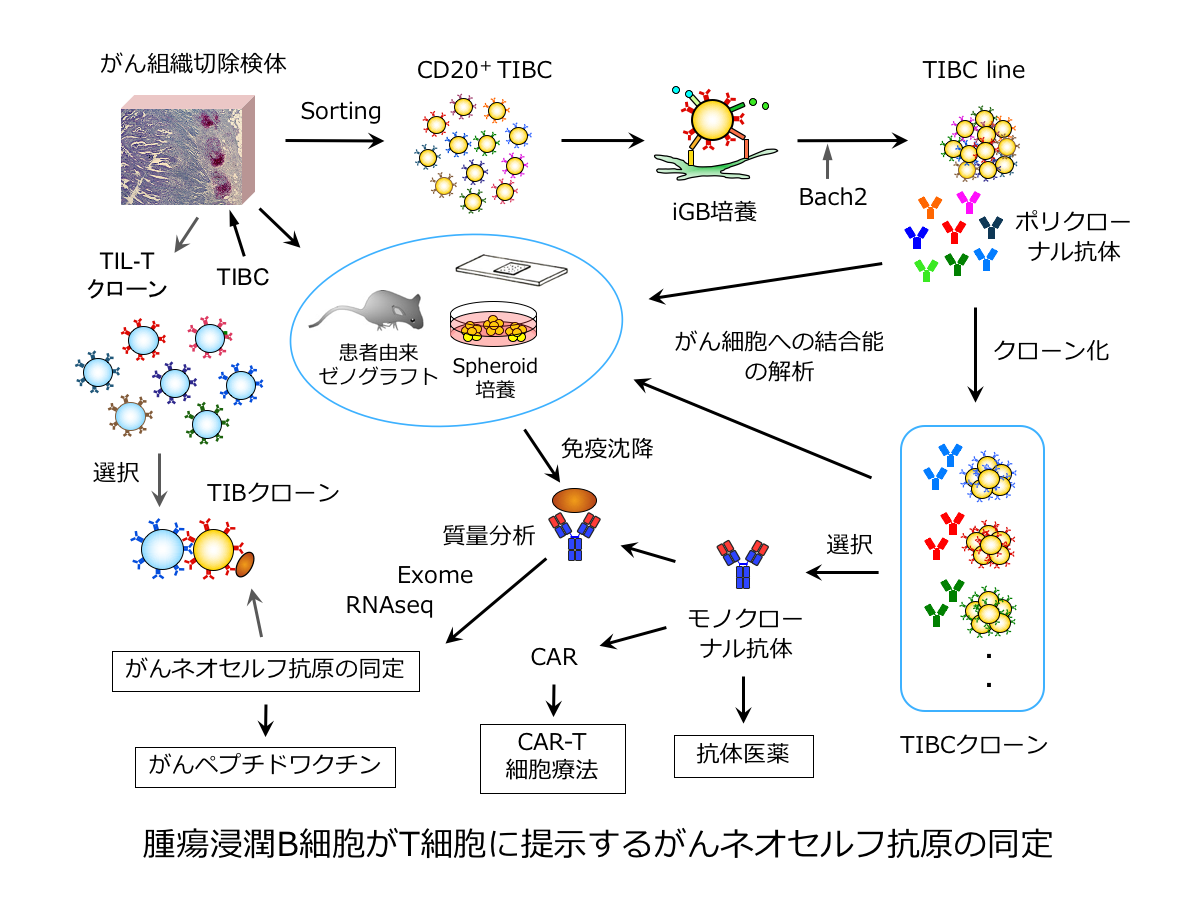
多くのがん細胞はゲノム変異によりネオセルフ抗原を発現し、それがT細胞の標的となります。この免疫応答を促進するのが免疫チェックポイント阻害薬です。腫瘍に浸潤するT細胞(TIL-T)は以前から免疫細胞療法に使われていますが、TIL-Tが認識するネオセルフ抗原の本態はあまり分かっていません。一方、腫瘍浸潤B細胞(TIBC)もがん抗原に反応して活性化し、また、がん抗原をT細胞へ提示していると思われます。そこで、独自の技術でTIBCを培養し、産生した抗体を利用してがんネオセルフ抗原を認識するTIBCを特定します。そして、このTIBCの抗原受容体/抗体が結合し、提示するネオセルフ抗原を同定し、これを認識するTIL-Tクローンを特定します。この研究により、がんネオセルフ抗原に対するリンパ球の免疫応答の詳細を解明すると同時に、同じネオセルフ抗原を認識するTIBCとTIL-Tを用いた新たながん免疫細胞療法や、TIBC由来の抗体医薬やCARの創出をめざします。
Nat. Immunol., 19 (9):1025-34, 2018. doi: 10.1038/s41590-018-0177-0.
Nat Immunol., 17(9):1109-17, 2016. doi: 10.1038/ni.3508.
Nat Commun., 2:465, 2011. doi: 10.1038/ncomms1475.
口腔感染症において病原微生物がネオ・セルフとしてはたす役割の解明
| 研究代表者 |  |
田中 芳彦 | 福岡歯科大学 機能生物化学講座 感染生物学分野 教授 研究室HPへ(http://www.fdcnet.ac.jp/col/department_graduate_school/div_info/div_info_kinou) |
研究概要
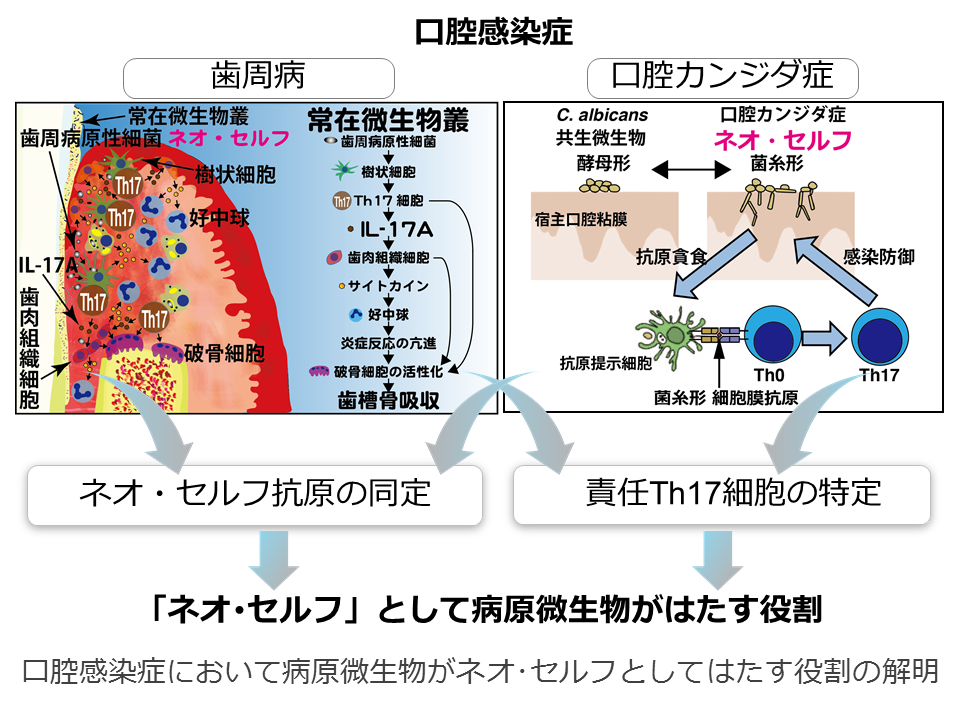
ヒトは自分自身の細胞や器官だけではなく「共生する微生物」によって身体が構成されています。免疫系は異物を排除するために備わっていますが、共生がどのように維持され、それが破綻して常在微生物による疾患を発症するのかほとんど明らかになっていません。歯周病は口腔内常在細菌によって引き起こされる疾患で、その病態がTh17細胞を介した免疫応答による歯周囲組織の破壊であることが明らかになっています。また、口腔カンジダ症においては、常在の酵母形カンジダ真菌が形態変化した菌糸形の細胞膜分画にネオ・セルフ抗原があり、それを認識するTh17細胞によって病態が制御されていることを我々は明らかにしました。本研究は最も多種多様な常在微生物叢を形成している口腔を対象に、歯周病と口腔カンジダ症を病態モデルとして病原微生物がネオ・セルフとしてはたす役割を解明していきます。
Med. Mycol. J. 60: 29-37, 2019. doi: 10.3314/mmj.19-00001.
FEMS Yeast Res. 18(3): foy018, 2018. doi: 10.1093/femsyr/foy018.
Sci. Rep. 7: 17402, 14 pages, 2017. doi: 10.1038/s41598-017-17597-3.
ネオ・セルフ抗原認識をT細胞分化制御に転換する分子機構の解明
| 研究代表者 |  |
谷内 一郎 | 理化学研究所 統合生命医科学研究センター 免疫転写制御研究グループ グループディレクター 研究室HPへ(http://www.ims.riken.jp/labo/20/) |
研究概要
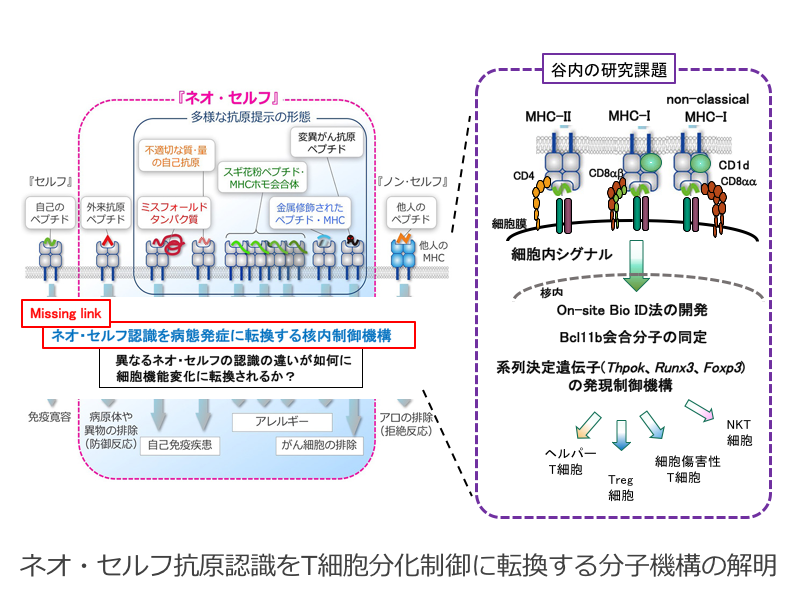
ネオセルフ抗原認識が関与する免疫応答メカニズムを解明することを目的とする本新学術領域において、T 細胞抗原受容体(TCR)によるネオ・セルフ抗原認識に起因するTCR信号の微細な変化が如何に病的なT細胞分化に繋がるか理解することが重要である。
本研究では、TCR信号を細胞分化制御に転換する核内装置の分子実体を明らかにし、ネオ・セルフ抗原による疾患発症メカニズムの理解に貢献することを目的に、T細胞系列決定遺伝子群の発現誘導に深く関与するBcl11b転写因子と会合する分子の同定とその機能解明、特定のゲノム制御領域上の生体分子の網羅的同定する手法としてOn-site BioID法の開発を行う。また、NKT細胞サブセット分化をモデルに非古典的MHC-I分子により提示されるネオ・セルフ抗原の認識機構におけるCD8分子の機能解明を行う。
Nat Commun., 10(1):447, 2019. doi: 10.1038/s41467-019-08365-0
Nat. Commun., 9(1):3593, 2018. doi: 10.1038/s41467-018-05803-3.
J. Exp. Med., 215(2):595, 2018. doi: 10.1084/jem.20171221.
胸腺依存的自己寛容を誘導する新規転写因子の欠損によるネオ・セルフ形成
| 研究代表者 |  |
秋山 伸子 | 理化学研究所 生命医科学研究センター 疾患遺伝研究チーム 上級研究員 研究室HPへ(http://www.ims.riken.jp/labo/28/index_j.html) |
研究概要
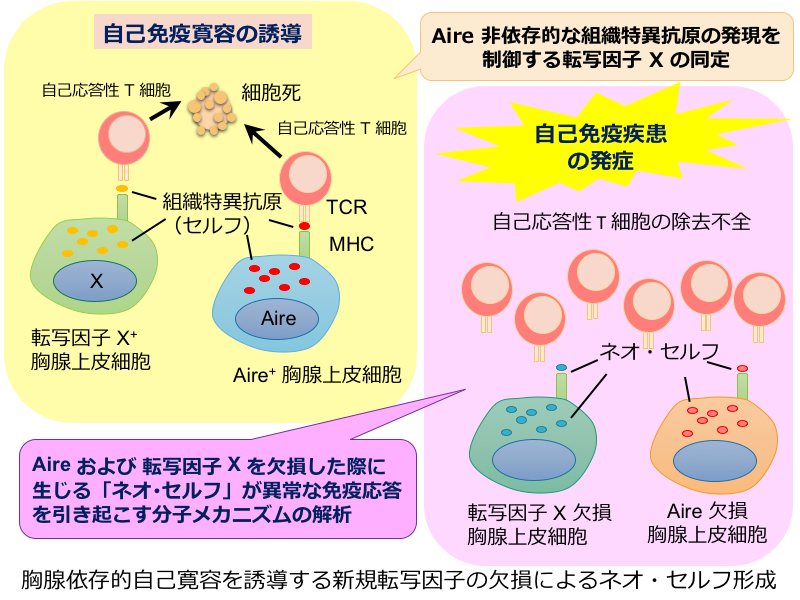
胸腺髄質上皮細胞は、自己免疫疾患の発症抑制に必要な抗原提示細胞である。核内因子 Aire は髄質上皮細胞による自己抗原の発現を制御し、自己免疫寛容を誘導する。Aire の機能欠損による自己免疫疾患の発症機構や、提示される抗原の質的・量的変化(本領域内でネオ・セルフと定義)について、領域代表の松本らにより研究が進められている。一方、我々は髄質上皮細胞の分化と機能の制御機構に関する研究の過程で、髄質上皮細胞において自己抗原の発現を制御し、免疫寛容を誘導する新たな転写因子を同定した(転写因子 X と略)。本研究は転写因子 X による自己抗原の発現誘導機構を明らかにする。また転写因子 X の機能不全により生じるネオ・セルフの実態を遺伝子レベルとタンパク質レベルで検討し、疾患発症へのプロセスを明らかにする。Aire および転写因子 X による胸腺におけるネオ・セルフ形成の全貌解明を目指す。
J Exp Med., 213(8):1441-1458, 2016. doi: 10.1084/jem.20151780.
J Exp Med., 211(12):2425-2438, 2014. doi: 10.1084/jem.20141207.
Biochem. Biophys. Res. Commun., 501(3):745-750, 2018. doi: 10.1016/j.bbrc.2018.05.060.
CD4T細胞による「セルフ」の攻撃に作用する「ネオセルフ」抗原刺激の追求
| 研究代表者 |  |
関谷 高史 | 国立研究開発法人国立国際医療研究センター 肝炎・免疫研究センター 免疫制御研究部 室長 研究室HPへ(http://www.page.sannet.ne.jp/takakis/) |
研究概要
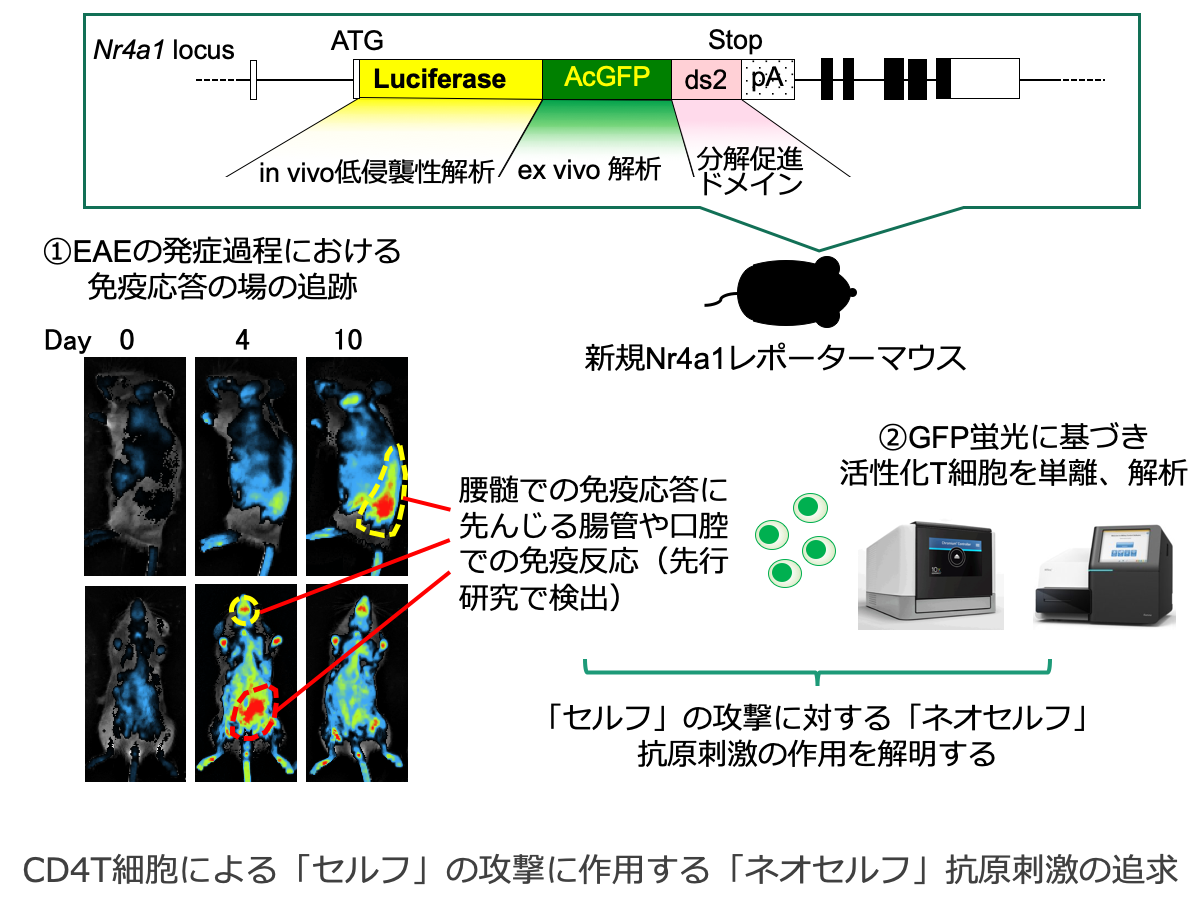
様々な免疫関連疾患では、獲得免疫系による「セルフ」抗原の認識により発症の直接の引き金が引かれるが、そこに至るまでの過程で、微生物抗原を始めとした「ネオセルフ」抗原の作用が病態を左右することが示唆されてきている。本研究では、抗原受容体刺激を受けて活性化したT細胞をin vivoライブイメージングとex vivo FACS解析の両方で捉えることが可能な「Nr4a1新規レポーターマウス」を用い、自己免疫疾患の発症過程におけるネオセルフ抗原刺激の関与を検討する。さらに、このマウスでは病態と照らし合わせてT細胞の活性化イベントを継続的にモニタリングすることができるという強みを活かし、疾患マウスモデルで頻繁に見られる「病態のheterogeneity」に言及することで、「無発症」や「自然寛解」など、従来のレトロスペクティブな実験系では解析が困難であった現象に対するネオセルフ抗原刺激の関与も検討する。
Cell Rep., 24(6):1627-1638.e6, 2018. doi:10.1016/j.celrep.2018.07.008
J Exp Med., 212(10):1623-1640, 2015. doi: 10.1084/jem.20142088
Nat Immunol., 14:230-237, 2013. doi: 10.1038/ni.2520
公募研究A02 ネオ・セルフの構造的理解
小胞体内MHCの立体構造構築の理解
| 研究代表者 |  |
奥村 正樹 | 東北大学学際科学フロンティア研究所 新領域創成研究部 助教 研究室HPへ(http://www.fris.tohoku.ac.jp/researcher/creative/okumura.html) |
| 連携研究者 | 稲葉 謙次 | 東北大学多元物質科学研究所 教授 | |
| 連携研究者 | 前仲 勝実 | 北海道大学薬学研究院 教授 | |
| 連携研究者 | 木下 岬 | 東北大学学際科学フロンティア研究所 博士研究員 |
研究概要
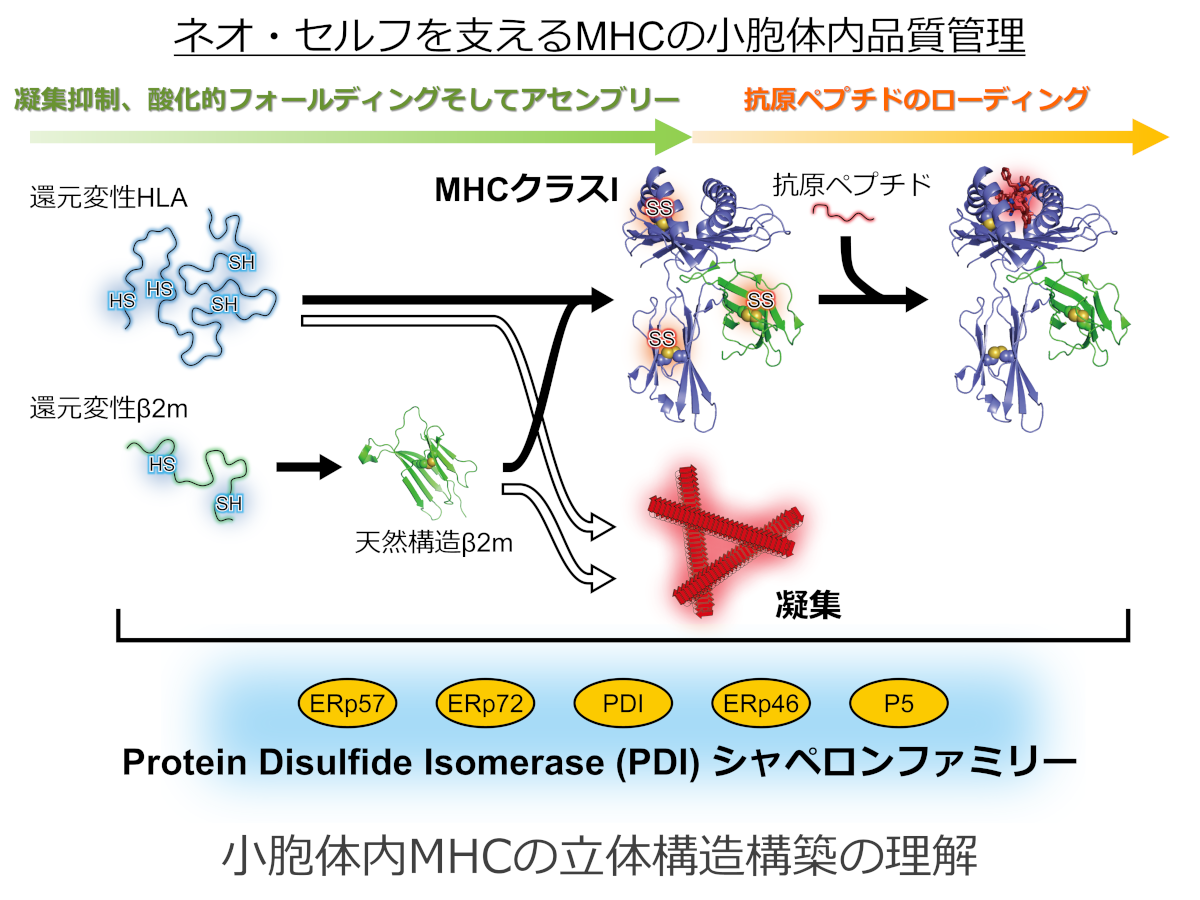
HLAにおいて、なぜ多様性に富んだ分子型がさまざまな病気への応答と関連するのか(分子構造の多様性)という未解決な重要な課題があります。また、MHCを構成するb2m のD76N 変異体は分解されず構造不安定化な状態で輸送され全身性アミロイドーシスとして振舞う問題点もあります。そこで本課題では、従来申請者が行ってきた「小胞体内タンパク質品質管理の理解」を発展させ、新たに「小胞体からの輸送経路の理解」まで拡張した視点から、MHC クラスⅠの立体構造構築原理を探究します。すなわち、オルガネラ間を舞台としたMHC クラスⅠの「フォールディング」「凝集抑制」「複合体の形成」「輸送や逆行輸送における分子認識」反応を補助する品質管理の理解を目指し、ネオセルフを制御するために重要な生体内恒常性維持メカニズム「タンパク質品質管理機構」と「分泌経路」の精巧な連携に関する理解に果敢に挑戦します。
Nat Chem Biol in press
Angew Chem Int Ed Engl., 56(20):5522-5526, 2017. doi: 10.1002/anie.201701654.
Free Radic Biol Med., 83:314-22, 2015. doi: 10.1016/j.freeradbiomed.2015.02.010.
造血細胞移植に関わる新たなアロ免疫認識機構の解明
| 研究代表者 |  |
森島 聡子 | 琉球大学 大学院医学研究科 内分泌代謝・血液・膠原病内科学講座 准教授 研究室HPへ(https://www.ryudai2nai.com/) |
| 連携研究者 | 森島 泰雄 | 愛知医科大学 医学部 造血細胞移植振興寄附講座 客員教授 |
研究概要
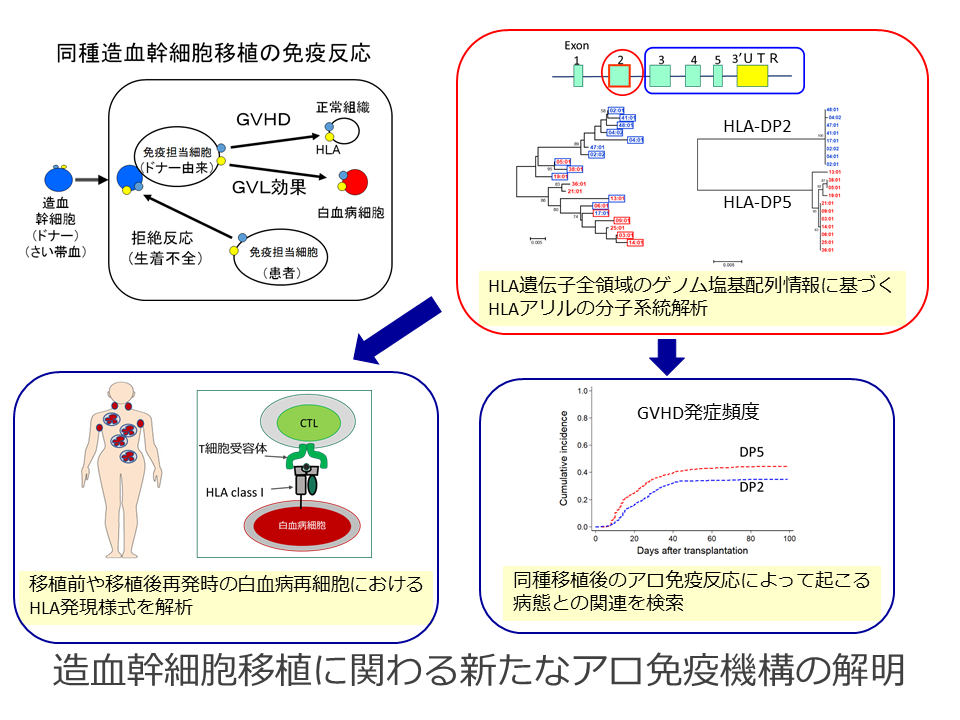
ヒト組織適合性抗原(HLA)はペプチドと結合して細胞表面上に提示され、T細胞受容体のリガンドとなって免疫応答を惹起するために必須の分子です。HLA遺伝子群はヒトゲノムの中で最も多型性に富み、同種造血幹細胞移植においてはドナー由来の細胞によって惹起される移植片対宿主病(GVHD)や移植片対白血病効果(GVL効果)などのアロ免疫反応に重要な役割を担っています。本研究では、日本人の主要なHLA遺伝子全領域のゲノム塩基配列情報に基づいて、HLAアリルの分子系統解析を行い、移植後のアロ免疫によって起こる病態とHLAの関連を解析し、新たなアロ免疫認識機構を検索します。さらに、移植前や移植後再発時の白血病再細胞におけるHLA発現様式を解析し、アロ免疫から回避して腫瘍が進展する機序を検索します。自己免疫疾患の機序とは異なった視点でネオ・セルフの認識機構を追及することを目指します。
Blood. 131(7):808-17, 2018. doi: 10.1182/blood-2017-08-801449.
Haematologica. 101(4):491-8, 2016. doi: 10.3324/haematol.2015.136903.
Blood. 115(23):4664-70, 2010. doi: 10.1182/blood-2009-10-251157.
光標識技術による細胞間相互作用の1細胞トランスリプトーム解析
| 研究代表者 |  |
口丸 高弘 | 自治医科大学 分子病態治療研究センター 講師 研究室HPへ(https://sites.google.com/view/takahirokuchimaru/) |
研究概要
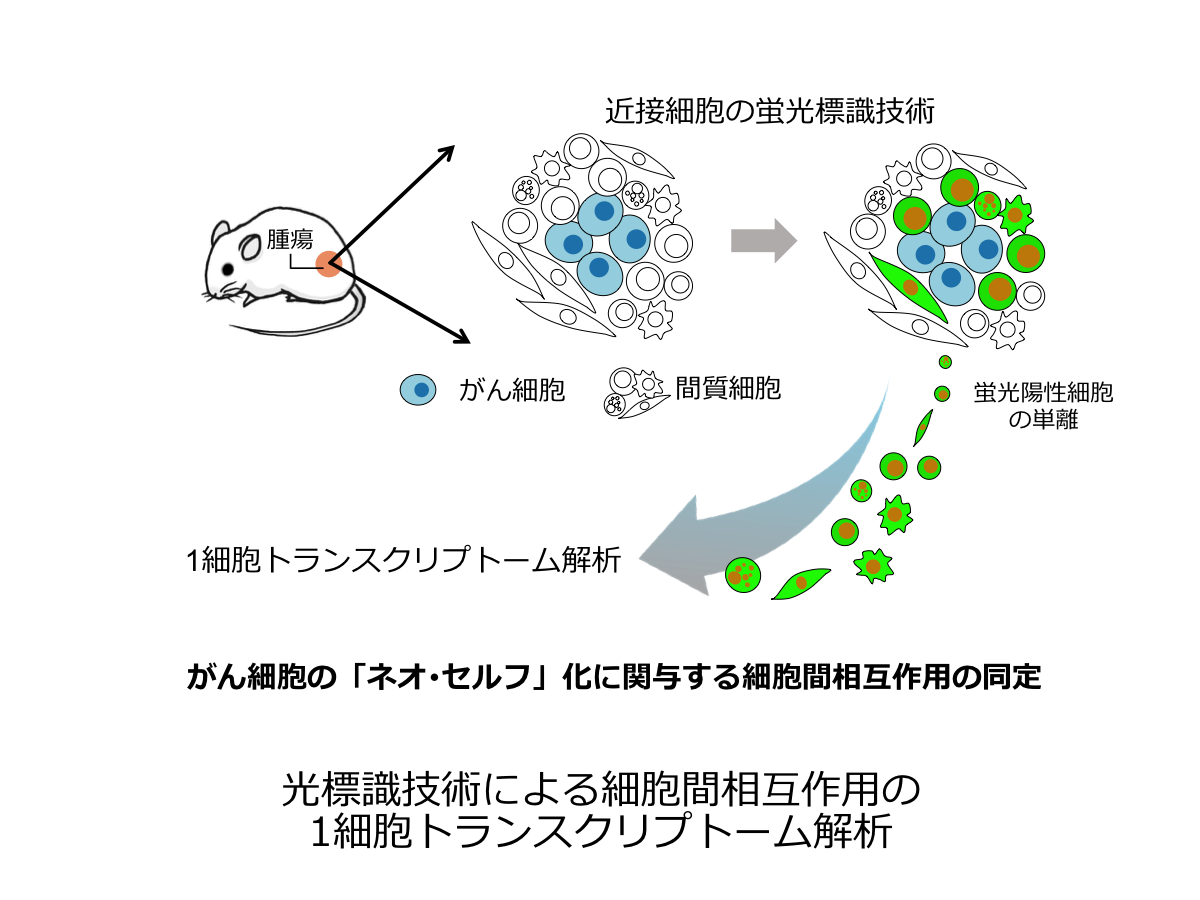
近年、1細胞トランスクリプトーム解析(SCTA)の技術進展によって生体組織における細胞の新たな動態 ・機能が明らかになりつつある。しかし、今現在のSCTAでは、細胞を回収する際に組織を破砕するため、組織中での細胞の空間情報が失われてしまう。本研究では、生体組織中で、特定の細胞と空間的に近接して相互作用する細胞をその場で蛍光標識する新規の遺伝子コード型レポーターシステムを開発する。破砕した生体組織から蛍光標識された細胞を単離し、SCTAによってその細胞系譜や細胞機能を解析する。そして、例えば、がん細胞のネオ・セルフ化に関わる新たな細胞間相互作用の発見を目指す。
Nat Commun., 9:12981, 2018. doi: 10.1038/s41467-018-05366-3.
Nat Commun., 7:11856, 2016. doi: 10.1038/ncomms11856.
Sci Rep., 6:34311, 2016. doi: 10.1038/srep34311.
