計画研究A01 ネオ・セルフの機能的理解
▼胸腺におけるネオ・セルフ生成機構 ▼金属・薬剤によるネオ・セルフの生成機構
▼腫瘍におけるネオ・セルフ生成機構 ▼ネオ・セルフ認識レセプターのレパートリー解析
胸腺におけるネオ・セルフ生成機構
| 研究代表者 |  |
松本 満 | 徳島大学 先端酵素学研究所 免疫病態学分野 教授 研究室HPへ(https://www.tokushima-autoimmunity.com/) |
| 分担研究者 |  |
吉開 泰信 | 九州大学 生体防御医学研究所附属感染ネットワーク研究センター 感染制御学分野 学術研究員 九州大学名誉教授 研究室HPへ(http://www.bioreg.kyushu-u.ac.jp/kansenseigyo/home0.html) |
| 連携研究者 | 村田 茂穂 | 東京大学 大学院薬学研究科 蛋白質代謝学教室 教授 |
松本班 研究概要
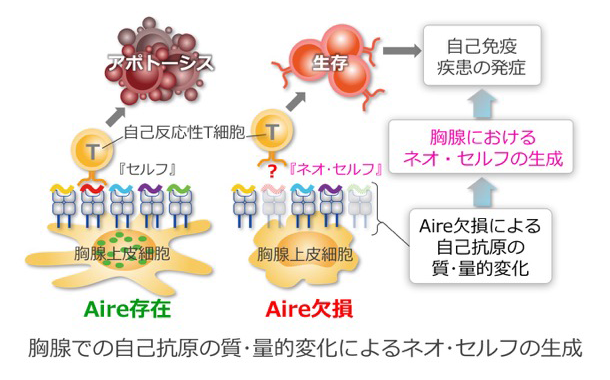
胸腺において、自分の身体の組織と反応するT細胞を取り除くにあたっては、胸腺上皮細胞が重要な役割を担います。すなわち、胸腺上皮細胞には全身に存在するさまざまな身体の成分を発現し、それをMHCとともにT細胞に提示するという特殊な機能が備わっています。このさまざまな身体の成分を発現するという興味深い現象に深く関わっているのがAireと呼ばれる転写調節因子です。実際、Aire遺伝子に異常をもつヒトやマウスでは自己反応性T細胞の除去や制御性T細胞の産生に異常がみられ、自己免疫疾患を発症します。本計画研究では、Aireの機能障害によって胸腺上皮細胞が発現する免疫学的な自己の総体にどのような変化がみられ、その結果、自己寛容の破綻へとつながるかをAire遺伝子改変マウスを用いて明らかにします。特に重要な課題は、Aire欠損によって認められる胸腺上皮細胞からの自己抗原の発現低下が自己免疫病態の直接原因であるとする現行のモデルを今一度検証することと、Aireを欠損した胸腺上皮細胞が発現する「ネオ・セルフ」の実体がどのようなものであるかを明らかにすることだと考えています。
J Immunol. 195(11):5149-58, 2015. doi: 10.4049/jimmunol.1501000.
J Immunol. 195(10):4641-9, 2015. doi: 10.4049/jimmunol.1501026.
J Immunol. 192(6):2585-92, 2014. doi: 10.4049/jimmunol.1302786.
Eur J Immunol. 41(1):12-7, 2011. doi: 10.1002/eji.201041024.
J Exp Med. 207(5):963-71, 2010. doi: 10.1084/jem.20092144.
吉開班 研究概要
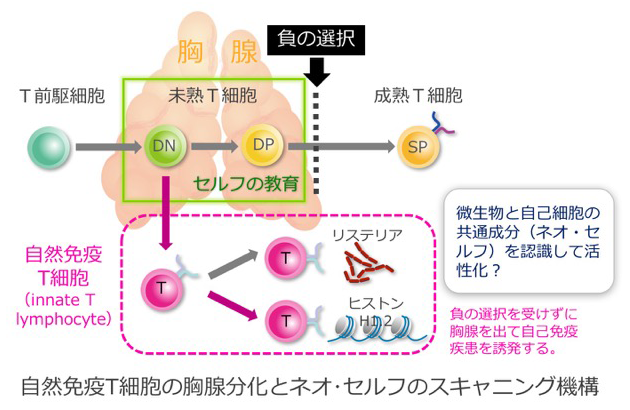
胸腺で負の選択をうけたconventional T cellsは末梢リンパ組織で外来抗原に出会ってはじめてサイトカイン産生能やキラー活性能を獲得します。一方、innate T cellsは胎児胸腺で分化する過程で既にインターロイキン17A (IL-17A)やγインターフェロン(IFN-γ)の産生能やキラー活性を有しており、末梢粘膜組織での感染初期防御や全身性自己免疫病のエフェクターT細胞となります。 我々はinnate T cellsが胎生早期の胸腺でCD4+ CD8+ double positive (DP) ステージを経ずにCD4- CD8-double negative (DN)2ステージから直接分化することを見いだしました。本研究では、新たに見いだしたいinnate T cellsの胸腺内分化におけるネオ・セルフスキャンニング機構、末梢でのネオセルフ認識機構、および粘膜面での生体防御機構での役割を明らかにしていきます。
Nat Commun. 25;6:7464, 2015. doi: 10.1038/ncomms8464.
J Autoimmun. 57:14-23, 2015. doi: 10.1016/j.jaut.2014.11.005.
J Immunol. 192(5):2210-8, 2014. doi: 10.4049/jimmunol.1302145.
Mucosal Immunol. 6(6):1191-201, 2013. doi: 10.1038/mi.2013.18.
Blood. 118(3):586-93, 2011. doi: 10.1182/blood-2011-02-334995.
金属・薬剤によるネオ・セルフの生成機構
| 研究代表者 |  |
小笠原 康悦 | 東北大学 加齢医学研究所生 体防御学分野 教授 研究室HPへ(http://www2.idac.tohoku.ac.jp/dep/imbio/) |
小笠原班 研究概要
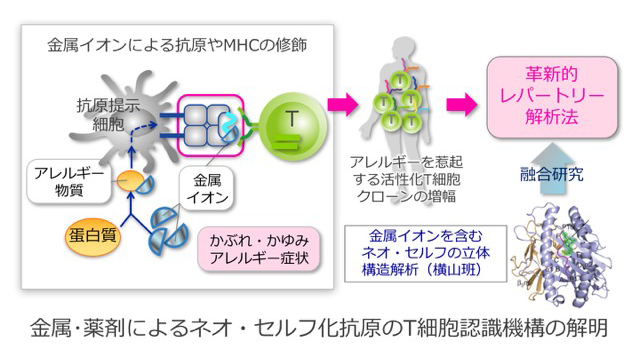
免疫応答には、タンパク質が分解され特徴的なペプチド配列が抗原として提示されます。これまで、ペプチドに対するT細胞受容体の解析は数多く成されてきましたが、金属や薬剤は、生体内ではイオンや低分子化合物であって、ペプチドとして抗原提示される訳ではありません。このような作用をもつ金属や薬剤は、ハプテンと呼ばれていて抗原ペプチドを修飾することによって、免疫学的な作用を発揮すると考えられていますが、その実態についてはよくわかっていません。すなわち、ハプテンはそれ自身では抗原性を発揮しないのですが、自己(セルフ)のペプチドを修飾することで、新たな自己抗原(ネオ・セルフ)となるものと考えられます。
T細胞は膨大な種類の病原微生物に対応するため、理論値として1018通りものレパートリーをもっています。そのため、ある抗原に反応するT細胞を特定するには、この膨大なレパートリーを網羅的に解析する必要があります。そこで研究代表者は、独創的アイデアによりT細胞受容体レパートリーを網羅的に計測するシステムを開発しました。この最新技術を活用して、金属や薬剤によって引き起こされる、ネオ・セルフの生成機構に迫ることを目標にしています。
Int Immunopharmacol. 35:70-6, 2016. doi: 10.1016/j.intimp.2016.03.021.
Exp Hematol. 44(2):116-24, 2016. doi: 10.1016/j.exphem.2015.11.002.
PLoS One. 9(2):e86810, 2014. doi: 10.1371/journal.pone.0086810.
Proc Natl Acad Sci U S A. 110(23):9421-6, 2013. doi: 10.1073/pnas.1300140110
Proc Natl Acad Sci U S A. 108(45):18360-5, 2011. doi: 10.1073/pnas.1110584108.
腫瘍におけるネオ・セルフ生成機構
| 研究代表者 |  |
宇高 恵子 | 高知大学 教育研究部 医療学系 教授 大学HPへ(https://www.kochi-ms.ac.jp/html/gakubu/ff_immnl.html) 研究室HPへ(http://www.kochi-ms.ac.jp/~ff_immnl/) |
| 分担研究者 |  |
西村 泰治 | 熊本大学 大学院生命科学研究部 免疫学講座 シニア教授 研究室HPへ(https://www.immunology-kumamoto.com/) |
| 連携研究者 | 西川 博嘉 | 国立がん研究センター 先端医療開発センター 免疫TR分野 分野長 名古屋大学 大学院医学系研究科 分子細胞免疫学 教授 |
宇高班 研究概要
腫瘍抗原ペプチド同定し、自己成分である腫瘍細胞をネオ・セルフとして攻撃するT細胞を増やし、腫瘍組織に浸潤させる方法を開拓したいと思います。現在、免疫チェックポイント阻害抗体の導入が進んでいますが、効果は自然に腫瘍特異的T細胞が増えている症例に限られます。私たちは、個人ごとに異なるMHC class I、class II分子に結合するペプチドを、コンピューターを使って同定し、特異的T細胞を攻撃的に増やす方法を開発します。また私たちは、血液を巡回するT細胞が、腫瘍組織の血管内皮細胞(EC)が提示する腫瘍ペプチドを認識して、“抗原依存性に”浸潤することを明らかにしました。この、腫瘍組織の玄関となるECの抗原提示のしくみを解明し、抗腫瘍効果を格段に向上させたいと思います。また、ECが組織特異的自己免疫疾患においても、T細胞が侵入する玄関となる可能性について研究を進めます。そして、組織抗原の自己・非自己の境界がネオ・セルフとして攻撃的に脅かされる環境要因を、抗原提示の視点から掘り下げたいと思います。最後に、現在は困難である、特定の抗原に対する免疫応答だけを増強したり、逆に抑制したりする方法の開発にチャレンジします。
Eur J Immunol., 39(1):96-112, 2009. doi: 10.1002/eji.200838796.
J Immunol., 169(10): 5744-53, 2002.
J Immunol., 164(4):1873-80, 2000.
J Immunol., 157(2): 670-8, 1996.
Cell., 69(6):989-98, 1992.
西村班 研究概要
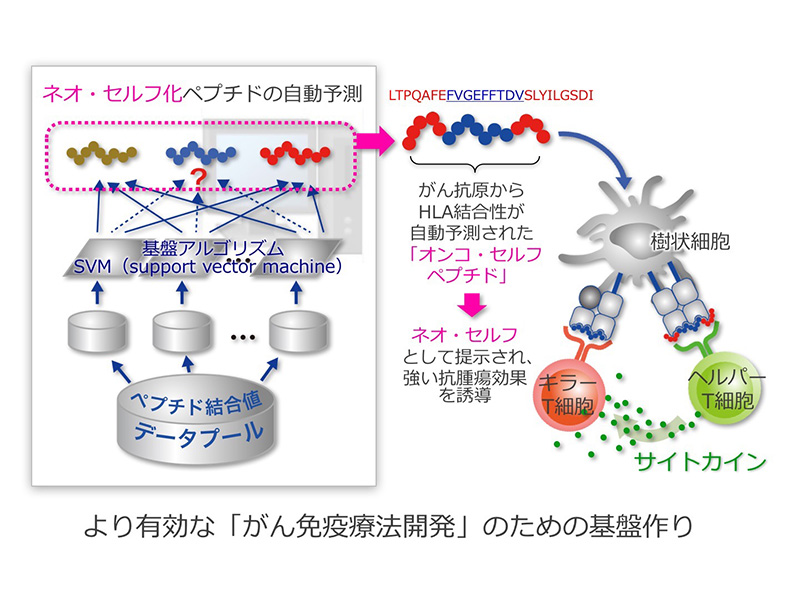
免疫系のT細胞は、がん細胞の表面に発現するHLA分子に結合した、がん細胞に特有のネオ・セルフの性格を有するタンパク質(がん抗原)が分解されて出来たペプチドを認識して、がん細胞を破壊します。HLA分子は人類が持つ遺伝子の中でも、最も多型性(個人差)に富み、その型の不一致が臓器移植において強い拒絶反応を誘導します。この多型はHLA分子のペプチドを収容する溝の部分に特に顕著であり、個人ごとにHLAの型が異なれば、結合するペプチドの性状(アミノ酸配列)も異なります。さらにHLAには、がん細胞などを殺すキラーT細胞に、短いがん抗原ペプチドを提示するクラスⅠ分子と、免疫細胞の活性を調節する物質(サイトカイン)を分泌するヘルパーT細胞に、長いがん抗原ペプチドを提示するクラスⅡ分子があります。本研究では、私どもが新規に発見したがん抗原に由来するペプチドで、キラーT細胞とヘルパーT細胞を共に活性化できる、20数個のアミノ酸により構成される長いペプチドを見つけ、がん細胞を破壊する2種類のT細胞を活性化できるがんワクチンの開発法を確立します。また、がん抗原を認識するT細胞に発現するT細胞レセプターを解析し、がん免疫療法の効果判定や、がん治療法の開発に利用します。さらに、担がん個体に生じる様々な免疫抑制状態を解明し、これを解除する治療法を開発して、がんワクチンとの併用による効果の増強を目指すべく、基礎免疫学の研究を遂行いたします。
Nat Commun., 6:6702, 2015. doi: 10.1038/ncomms7702.
Clin Cancer Res. 21(2):312-21, 2015. doi: 10.1158/1078-0432.CCR-14-0202.
Onco Immunology. 3:e28100, 2014. doi:10.4161/onci.28100.
Science. 345(6195):455-9, 2014. doi: 10.1126/science.1249749.
Clin Cancer Res. 19(16):4508-20, 2013. doi: 10.1158/1078-0432.CCR-13-0197.
ネオ・セルフ認識レセプターのレパートリー解析
| 研究代表者 |  |
岸 裕幸 | 富山大学 大学院医学薬学研究部(医学)免疫学 准教授 研究室HPへ(http://www.med.u-toyama.ac.jp/immuno/top.html) |
| 連携研究者 | 浜名 洋 | 富山大学 大学院医学薬学研究部(医学) 免疫学 助教 | |
| 小澤 龍彦 | 富山大学 大学院医学薬学研究部(医学) 免疫学 助教 |
岸班 研究概要
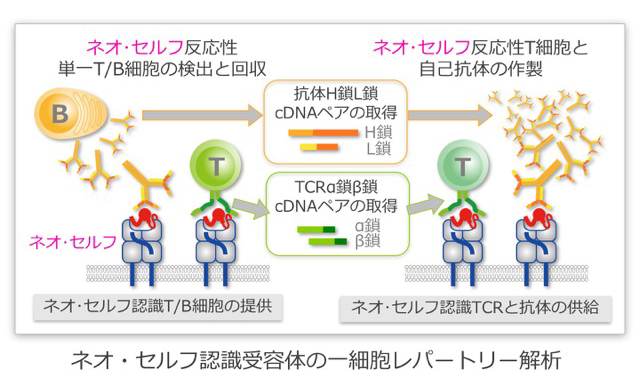
本研究領域では、ネオ・セルフの解析を通し、自己免疫疾患やアレルギー、腫瘍免疫の機序を明らかにし、その制御法を開発していきます。免疫細胞によるネオ・セルフの認識には、抗原受容体が重要な働きをします。私たちは、まず、ネオ・セルフに反応するT細胞やB細胞を簡便に検出する方法を確立し、その方法を用いて、ネオ・セルフ反応性免疫細胞を同定します。次に、同定した細胞から、ネオ・セルフを認識する受容体を取得し、その受容体とネオ・セルフとの相互作用を細胞レベル・分子レベルで解析し、ネオ・セルフと認識受容体との反応様式を詳細に解析します。具体的には、本研究領域の他の班で明らかにされたネオ・セルフを基に、それを認識する抗原受容体を同定するための材料、例えば、ネオ・セルフマルチマーを作製します。作製したネオ・セルフマルチマーやネオ・セルフを提示する細胞を用いて、ネオ・セルフを認識するT細胞受容体やB細胞受容体を迅速・高効率にクローニングします。取得した認識受容体を免疫細胞に発現させ、認識受容体とネオ・セルフとの反応様式を解析したり、可溶化した認識受容体とネオ・セルフとの結晶構造を解析したりすることにより、ネオ・セルフと認識受容体との反応様式を細胞レベル・分子レベルで詳細に解析していきます。
Sci Transl Med. 7(310):310ra167, 2015. doi: 10.1126/scitranslmed.aac5477.
Arthritis Rheumatol. 67(8):2020-31, 2015. doi: 10.1002/art.39161.
Biochem Biophys Res Commun. 453(4):798-803, 2014. doi: 10.1016/j.bbrc.2014.10.024.
Nat Med. 19(11):1542-6, 2013. doi: 10.1038/nm.3358.
Nat Protoc. 6(5):668-76, 2011. doi: 10.1038/nprot.2011.322.
